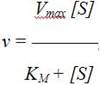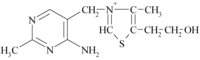Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Строение и классификация аминокислот. Их физико-химические свойства. Методы разделения белков по физико-химическим свойствам.Содержание книги
Поиск на нашем сайте
Конформационные изменения белков как основа функционирования и саморегуляции белков. Нативные белки. Факторы денатурации и ее механизм. Нативныйбелок — естественный, натуральный, неповрежденный при исследовании; в мол. биологии термин используется для описания молекул белка, нуклеиновых кислот в естественном состоянии для противопоставления денатурированному состоянию Внешние проявления денатурации сводятся к потере растворимости, особенно в изоэлектрической точке, повышению вязкости белковых растворов, увеличению количества свободных функциональных SH-групп и изменению характера рассеивания рентгеновских лучей. Наиболее характерным признаком денатурации является резкое снижение или полная потеря белком его биологической активности (каталитической, антигенной или гормональной). При непродолжительном действии и быстром удалении денатурирующих агентов возможна ренатурация белка с полным восстановлением исходной трехмерной структуры и нативных свойств его молекулы, включая биологическую активность. Таким образом, при денатурации белковая молекула полностью теряет биологические свойства, демонстрируя тем самым тесную связь между структурой и функцией. Различают три основных этапа ферментативного катализа. 1 этап. 2 этап.
Этап. Десорбция готового продукта из его комплекса с ферментом. Этот этап протекает легче, чем 2-й. Он, как и 2-й этап, тоже необратим. Исключение - обратимые ферментативные реакции.
21. Зависимость скорости ферментативных реакций от температуры, рН, концентрации ферментов и субстрата.
Рассмотрим влияние концентрации субстрата на скорость ферментативной реакции (рис. 30.). При низких концентрациях субстрата скорость прямо пропорциональна его концентрации, далее с ростом концентрации скорость реакции увеличивается медленнее, а при очень высоких концентрациях субстрата скорость практически не зависит от его концентрации и достигает своего максимального значения (Vmax). При таких концентрациях субстрата все молекулы фермента находятся в составе фермент-субстратного комплекса, и достигается полное насыщение активных центров фермента, именно поэтому скорость реакции в этом случае практически не зависит от концентрации субстрата.
Рис. 30. Зависимость скорости ферментативной реакции от концентрации субстрата
График зависимости активности фермента от концентрации субстрата описывается уравнением Михаэлиса – Ментен, которое получило свое название в честь выдающихся ученых Л.Михаэлиса и М.Ментен, внесших большой вклад в исследование кинетики ферментативных реакций,
где v – скорость ферментативной реакции; [S] – концентрация субстрата; KM – константа Михаэлиса. Рассмотрим физический смысл константы Михаэлиса. При условии, что v = ½ Vmax, получаем KM = [S]. Таким образом, константа Михаэлиса равна концентрации субстрата, при которой скорость реакции равна половине максимальной. Скорость ферментативной реакции зависит и от концентрации фермента (рис. 31). Эта зависимость носит прямолинейный характер.
Рис. 31. Зависимость скорости ферментативной реакции от концентрации фермента Водорастворимые
Жирорастворимые
Водорастворимые витамины при их избыточном поступлении в организм, будучи хорошо растворимыми в воде, быстро выводятся из организма. Жирорастворимые витамины хорошо растворимы в жирах и легко накапливаются в организме при их избыточном поступлении с пищей. Их накопление в организме может вызвать расстройство обиена веществ, называемое гипервитаминозом, и даже гибель организма. Витамины участвуют во множестве биохимических реакций, выполняя каталитическую функцию в составе активных центров большого количества разнообразных ферментов либо выступая информационными регуляторными посредниками, выполняя сигнальные функции экзогенных прогормонов и гормонов. Они не являются для организма поставщиком энергии и не имеют существенного пластического значения. Однако витаминам отводится важнейшая роль в обмене веществ. Концентрация витаминов в тканях и суточная потребность в них невелики, но при недостаточном поступлении витаминов в организм наступают характерные и опасные патологические изменения. Большинство витаминов не синтезируются в организме человека. Поэтому они должны регулярно и в достаточном количестве поступать в организм с пищей или в виде витаминно-минеральных комплексов и пищевых добавок. С нарушением поступления витаминов в организм связаны 3 принципиальных патологических состояния: недостаток витамина —гиповитаминоз, отсутствие витамина — авитаминоз, и избыток витамина — гипервитаминоз.
обмен веществ и процессы минерализации. 29. Витамины группы Д. Провитамины, строение, превращение в активную форму, влияние на Кальциферолы - группа химически родственных соединений, относящихся к производным стеринов. Наиболее биологически активные витамины - D2 и D3. Витамин D2 (эргокалыщферол), производное эргостерина - растительного стероида, встречающегося в некоторых грибах, дрожжах и растительных маслах. При облучении пищевых продуктов УФО из эргостерина получается витамин D2, используемый в лечебных целях. Витамин D3, имеющийся у человека и животных, - холекальциферол, образующийся в коже человека из 7-дегидрохолестерина под действием УФ-лучей растворимые в жирах и органических растворителях.
Витамины D2 и D3 - белые кристаллы, жирные на ощупь, нерастворимые в воде, но хорошо
Образование ацетил-КоА и его транспорт в цитозоль Синтез жирных кислот происходит в абсорбтивный период. Активный гликолиз и последующее окислительное декарбоксилирование пирувата способствуют увеличению концентрации ацетил-КоА в матриксе митохондрий. Так как синтез жирных кислот происходит в цитозоле клеток, то ацетил-КоА должен быть транспортирован через внутреннюю мембрану митохондрий в цитозоль. Однако внутренняя мембрана митохондрий непроницаема для ацетил-КоА, поэтому в матриксе митохондрий ацетил-КоА конденсируется с оксалоацетатом с образованием цитрата при участии цитратсинтазы: Ацетил-КоА + Оксалоацетат -> Цитрат + HS-КоА. Затем транслоказа переносит цитрат в цитоплазму (рис. 8-35). Перенос цитрата в цитоплазму происходит только при увеличении количества цитрата в митохондриях, когда изоцитратдегидрогеназа и α-кетоглутаратдегидрогеназа ингибированы высокими концентрациями NADH и АТФ. Эта ситуация создаётся в абсорбтивном периоде, когда клетка печени получает достаточное количество источников энергии. В цитоплазме цитрат расщепляется под действием фермента цитратлиазы: Цитрат + HSKoA + АТФ → Ацетил-КоА + АДФ + Pi + Оксалоацетат. Ацетил-КоА в цитоплазме служит исходным субстратом для синтеза жирных кислот, а окса-лоацетат в цитозоле подвергается следующим превращениям (см. схему ниже). Пируват транспортируется обратно в матрикс митохондрий. Восстановленный в результате действия малик-фермента NADPH используется как донор водорода для последующих реакций синтеза жирных кислот. Другой источник NADPH - окислительные стадии пентозофосфатного пути катаболизма глюкозы.
Образование малонил-КоА из ацетил-КоА - регуляторная реакция в биосинтезе жирных кислот. Первая реакция синтеза жирных кислот - превращение ацетил-КоА в малонил-КоА. Фермент, катализирующий эту реакцию (ацетил-КоА-карбоксилаза), относят к классу лигаз. Он содержит ковалентно связанный биотин (рис. 8-36). В первой стадии реакции СО2 ковалентно связывается с биотином за счёт энергии АТФ, во второй стадии СОО- переносится на ацетил-КоА с образованием малонил-КоА. Активность фермента ацетил-КоА-карбоксилазы определяет скорость всех последующих реакций синтеза жирных кислот.
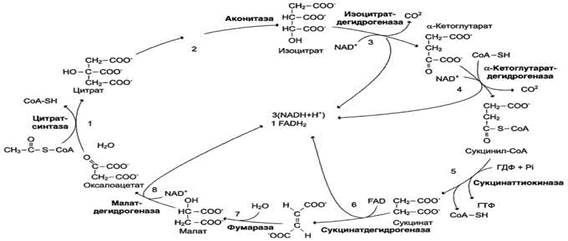
53 Цикл трикарбоновых кислот: последовательность реакций, характеристика ферментов. Связь между общими путями катаболизма и цепью переноса электронов и протонов. Цикл лимонной кислоты (цитратный цикл, цикл Кребса, цикл трикарбоновых кислот, ЦТК) - заключительный этап катаболизма, в котором углерод ацетильного остатка ацетил-КоА окисляется до 2 молекул СО2. Атомы водорода, освобождающиеся в окислительно-восстановительных реакциях, доставляются в ЦПЭ при участии NAD- и FAD-зависимых дегидрогеназ, в результате чего происходят синтез воды и окислительное фосфорилирование АДФ. Связь между атомами углерода в ацетил-КоА устойчива к окислению. В условиях организма окисление ацетильного остатка происходит в несколько этапов, образующих циклический процесс из 8 реакций:
Последовательность реакций цитратного цикла Образование цитрата
В реакции образования цитрата углеродный атом метильной труппы ацетил-КоА связывается с карбонильной группой оксалоацетата; одновременно расщепляется тиоэфирная связь и освобождается коэнзим A (ΔG0' = -37,6 кДж/моль). Равновесие реакции в клетке сильно сдвинуто вправо, о чём свидетельствует отрицательная величина стандартной свободной энергии. Реакция сопровождается потерей большого количества энергии в виде теплоты. Катализирует реакцию цитрат синтаза, фермент, локализованный в матриксе митохондрий. Дегидрирование сукцината
Образовавшийся на предьщущем этапе сукцинат превращается в фумарат под действием сукцинатдегидрогеназы. Этот фермент - флавопротеин, молекула которого содержит прочно связанный кофермент FAD. Сукцинат дегидрогеназа прочно связана с внутренней митохондриальной мембраной. Она состоит из 2 субъединиц, одна из которых связана с FAD. Кроме того, обе субъединицы содержат железо-серные центры; одна - Fe2S2, a другая - Fe4S4. В железо-серных центрах атомы железа меняют свою валентность, участвуя в транспорте электронов. Образование малата из фумарата
Образование малата происходит при участии фермента фумаратгидратазы. Этот фермент более известен как фумараза. Фумараза - олигомерный белок, состоящий из 4 идентичных полипептидных цепей. Он расположен в матриксе митохондрий. Фумаразу относят к ферментам с абсолютной субстратной специфичностью: она катализирует гидратацию только транс-формы фумарата. Дегидрирование малата
В заключительной стадии цитратного цикла малат дегидрируется с образованием оксалоа-цетата. Реакцию катализирует NAD-зависимая малатдегидрогеназа, содержащаяся в матриксе митохондрий. Равновесие малатдегидрогеназной реакции сильно сдвинуто влево. Тем не менее, в интактных клетках эта реакция идёт слева направо, потому что продукт реакции, оксалоацетат, активно используется в цитратсинтазной реакции. В цитозоле содержится изоформа малат-дегидрогеназы, также NAD-зависимая, но не принимающая участие в цитратном цикле. Обе изоформы малатдегидрогеназы - димеры.
54 Аллостерические механизмы регуляции цитратного цикла. Образование СО2 при тканевом дыхании. Анаболические функции ЦТК. Витамин В1 и пантотеновая кислота, их биологическая роль.
Аллостерическая регуляция Аллостерическими ферментами называют ферменты, активность которых регулируется не только количеством молекул субстрата, но и другими веществами, называемыми эффекторами. Участвующие в аллостерической регуляции эффекторы - клеточные метаболиты часто именно того пути, регуляцию которого они осуществляют. Роль аллостерических ферментов в метаболизме клетки. Аллостерические ферменты играют важную роль в метаболизме, так как они чрезвычайно быстро реагируют на малейшие изменения внутреннего состояния клетки. Аллостерическая регуляция имеет большое значение в следующих ситуациях: при анаболических процессах. Ингибирование конечным продуктом метаболического пути и активация начальными метаболитами позволяют осуществлять регуляцию синтеза этих соединений; при катаболических процессах. В случае накопления АТФ в клетке происходит ингибирование метаболических путей, обеспечивающих синтез энергии. Субстраты при этом расходуются на реакции запасания резервных питательных веществ; для координации анаболических и катаболических путей. АТФ и АДФ - аллостерические эффекторы, действующие как антагонисты; для координации параллельно протекающих и взаимосвязанных метаболических путей (например, синтез пуриновых и пиримидиновых нуклеотидов, используемых для синтеза нуклеиновых кислот). Таким образом, конечные продукты одного метаболического пути могут быть аллостерическими эффекторами другого метаболического пути.
Образование СО2 при тканевом дыхании. Напомним, что тканевое дыхание это процесс поглощения кислорода (О2) тканями при окислении органического субстрата с выделением углекислого газа и воды. Выше мы уже показали, как из атомов водорода в дыхательной цепи образуются молекулы воды. Однако процесс дегидрирования субстрата НАД и ФАДзависимыми дегидрогеназами одновременно ведет и к отщеплению концевой карбоксильной группы, которая выделяется в виде СО2. Главными источниками СО2 является реакции декарбоксилирования пировиноградной и альфакетоглутаровой кислот (см. выше). Еще один источник – это процесс декарбоксилиро вание аминокислот, который катализируется пиридоксальзависимыми ферментами. Витамин B1 (тиамин) 4-метил-5-
Витамин B1 - водорастворимый витамин, легко разрушается при тепловой обработке в щелочной среде. Фосфорилированная форма тиамина - тиаминпирофосфат - образуется в организме человека и является предшественником ферментов, которые играют существенную роль в обмене углеводов и, в частности, в процессах декарбоксилирования пировиноградной кислоты, -кетокислот. Действие Витамин B1 необходим для окислительного декарбоксилирования кетокислот, (пировиноградной и молочной), синтеза ацетилхолина, он участвует в углеводном обмене и связанных с ним энергетическом, жировом, белковом, водно-солевом обмене, оказывает регулирующее воздействие на трофику и деятельность нервной системы. При недостаточном поступлении тиамина пировиноградная и молочная кислоты накапливаются в тканях, нарушается синтез ацетилхолина, вследствие чего ухудшаются функции ряда систем, в первую очередь, нервной, сердечно-сосудистой и пищеварительной. Тиамин улучшает циркуляцию крови и участвует в кроветворении. Тиамин оптимизирует познавательную активность и функции мозга. Он оказывает положительное действие на уровень энергии, рост, нормальный аппетит, способность к обучению и необходим для тонуса мышц пищеварительного тракта, желудка и сердца. Тиамин выступает как антиоксидант, защищая организм от разрушительного воздействия старения, алкоголя и табака. Как и все витамины группы B, тиамин обладает хелатными свойствами. Симптомы гиповитаминоза При полном авитаминозе B1 развивается болезнь бери-бери: в организме нарушается углеводный обмен, и накапливаются молочная и пировиноградная кислоты. При этом наблюдаются поражения нервной системы (полиневриты, которые могут оканчиваться параличами), сердечной мышцы (она теряет способность эффективно сокращаться, сердце больного увеличивается, учащается пульс), пищеварительного тракта (снижается аппетит, появляются запоры). У больных наблюдается резкое общее истощение, распространенный или частичный отек. Первичными признаками развивающегося гиповитаминоза B1 являются: Со стороны нервной системы: повышенная раздражительность, ощущение внутреннего беспокойства, плаксивость, депрессия, бессонница (временами стойкая), снижение памяти, онемение рук и ног, боли, зуд, ухудшение координации, зябкость при комнатной температуре, нарушение функций мозга, повышенная умственная и физическая утомляемость; синдром Вернике-Корсакова (присущий больным, страдающим алкоголизмом). Со стороны пищеварительной системы: снижение аппетита, ощущение тяжести или жжения в подложечной области, тошнота, запоры, диарея, потеря веса, увеличение печени. Со стороны сердечно-сосудистой системы: одышка даже при небольшой физической нагрузке, тахикардия, артериальная гипотония, острая сердечно-сосудистая недостаточность (может развиться в некоторых случаях при отсутствии своевременной диагностики и назначения лечения). Дефицит витамина В1 в сыворотке крови встречается у 25% больных СПИДом. Хронический дефицит тиамина у больных СПИДом ведет к появлению различных неврологических симптомов, приводит к анорексии и снижению массы тела. Витамин В5 называют пантотеновой кислотой, потому что он очень часто встречается в природе: многие пищевые продукты богаты этим витамином. В греческом языке слово «pantoten» означает – «повсюду», так что недостаток витамина В5 при правильном подходе к питанию не грозит никому. Витамин В5 хорошо растворяется в воде, легко выводится из организма и совсем не токсичен. В организме пантотеновая кислота превращается в другие вещества, участвующие в процессах окисления и ацетилирования – способности организма осуществлять множество необходимых реакций. Витамин В5 очень важен для обмена и синтеза многих веществ: жирных кислот, гистамина, гемоглобина и т.д. Недостаток витамина В5 всегда считался достаточно редким явлением, однако сегодня всё изменилось. Раньше люди питались преимущественно тем, что готовили сами, а сегодня блюда покупают уже готовыми – в большинстве супермаркетов есть отделы готовой еды. Кроме того, часто употребляются консервы, белый хлеб и выпечка, чипсы, рафинированный сахар и сладости. В этих продуктах пантотеновой кислоты практически нет, как и веществ, которые должны с ней взаимодействовать. Можно сказать, что к тепловой обработке витамин В5 устойчив, если не превышать необходимой температуры. Если же продукты пережариваются, консервируются или замораживаются, то он разрушается; разрушает его приготовление блюд под давлением, долгое хранение и разогревание готовой пищи. А если полить блюдо соусом, в котором есть уксус, витамина В5 там не останется вообще. Так что готовить продукты с этим витамином нужно максимально щадящим и естественным способом, и есть поменьше полуфабрикатов, а также продуктов, предназначенных для долгого хранения. В каких продуктах содержится витамин B5 (пантотеновая кислота), источники витамина B5 Основными источниками пантотеновой кислоты являются говядина и говяжья печень, почки, морская рыба, яйца, молоко, свежие овощи, пивные дрожжи, бобовые, зерновые, орехи, грибы, маточное молочко пчёл, а также цельная пшеница и цельная ржаная мука. Витамин В5, как и другие витамины этой группы, может вырабатываться в кишечнике, если микрофлора в порядке. Строение и классификация аминокислот. Их физико-химические свойства. Методы разделения белков по физико-химическим свойствам. α-Аминокислоты представляют собой производные карбоновых кислот, у которых один водородный атом, у α-углерода, замещен на аминогруппу (—NH2).
Аминокислоты будут отличаться друг от друга химической природой радикала R, представляющего группу атомов в молекуле аминокислоты, связанную с α-углеродным атомом и не участвующую в образовании пептидной связи при синтезе белка. Почти все α-амино- и α-карбоксильные группы участвуют в образовании пептидных связей белковой молекулы, теряя при этом свои специфические для свободных аминокислот кислотно-основные свойства. Поэтому все разнообразие особенностей структуры и функции белковых молекул связано с химической природой и физико-химическими свойствами радикалов аминокислот. Именно благодаря им белки наделены рядом уникальных функций, не свойственных другим биополимерам, и обладают химической индивидуальностью. В состав белков входят 20 природных аминокислот. Кислотно-основные свойства. Эти свойства аминокислот определяют многие физико-химические и биологические свойства белков. На этих свойствах основаны, кроме того, почти все методы выделения и идентификации аминокислот. Аминокислоты легко растворимы в воде. Они кристаллизуются из нейтральных водных растворов в форме биполярных (амфотерных) ионов, а не в виде недиссоциированных молекул. В связи с этим, они могут проявлять как основные, так и кислотные свойства, что зависит еще от природы входящего в их состав радикала. Стереохимия аминокислот. Важнейшим свойством аминокислот, освобождающихся в процессе гидролиза природных белков в условиях, исключающих рацемизацию, является их оптическая активность. Это свойство связано с наличием в молекуле всех природных аминокислот (за ислючением глицина) в α-положении асимметрического атома углерода. Стереохимию аминокислот принято оценивать не по оптическому вращению, а исходя из абсолютной конфигурации всех четырех замещающих групп, расположенных вокруг асимметрического атома углерода в вершинах модели тетраэдра. Абсолютную конфигурацию аминокислот принято соотносить стереохимически с соединением, произвольно взятым для сравнения, а именно с глицериновым альдегидом, также содержащим асимметрический атом углерода. Все аминокислоты, образующиеся при гидролизе природных белков в условиях, исключающих рацемизацию, принадлежит к L-ряду. Таким образом, природные аминокислоты имеют пространственное расположение, аналогичное конфигурации L-глицеринового альдегида. Пептидная связь — вид амидной связи, возникающей при образовании белков и пептидов в результате взаимодействия α-аминогруппы (—NH2) одной аминокислоты с α-карбоксильной группой (—СООН) другой аминокислоты. Из двух аминокислот (1) и (2) образуется дипептид (цепочка из двух аминокислот) и молекула воды. По этой же схеме рибосома генерирует и более длинные цепочки из аминокислот: полипептиды и белки. 6. Молекулярный вес белков. Размеры и формы белковых молекул. Глобулярные и фибриллярные белки. Простые и сложные белки.
Индивидуальные белки различаются по своим физико-химическим свойствам: форме молекул, молекулярной массе, суммарному заряду молекулы, соотношению полярных и неполярных групп на поверхности нативной молекулы белка, растворимости белков, а также степени устойчивости к воздействию денатурирующих агентов. Различия белков по молекулярной массе. Б елки - высокомолекулярные соединения, но могут сильно отличаться по молекулярной массе, которая колеблется от 6000 до 1 000 000 Да и выше. Молекулярная масса белка зависит от количества аминокислотных остатков в полипептидной цепи, а для олигомерных белков - и от количества входящих в него протомеров (или субъединиц). Различия белков по форме молекул. П о форме молекул белки делят на глобулярные и фибриллярные. Глобулярные белки имеют более компактную структуру, их гидрофобные радикалы в большинстве своём спрятаны в гидрофобное ядро, и они значительно лучше растворимы в жидкостях организма, чем фибриллярные белки (исключение составляют мембранные белки). Различия по р астворимости белков. Растворимость белков в воде зависит от формы, молекулярной массы, величины заряда, соотношения полярных и неполярных функциональных групп на поверхности белка. Кроме этого, растворимость белка определяется составом растворителя, т.е. наличием в растворе других растворённых веществ. Например, некоторые белки легче растворяются в слабом солевом растворе, чем в дистиллированной воде. С другой стороны, увеличение концентрации нейтральных солей может способствовать выпадению определённых белков в осадок. Денатурирующие агенты, присутствующие в растворе, также снижают растворимость белков. Различия по гидратации. На поверхности большинства внутриклеточных белков преобладают полярные радикалы, однако соотношение полярных и неполярных групп отлично для разных индивидуальных белков. Так, протомеры олигомерных белков в области контактов друг с другом часто содержат гидрофобные радикалы. Поверхности белков, функционирующих в составе мембран или прикрепляющиеся к ним в процессе функционирования, также обогащены гидрофобными радикалами. Такие белки лучше растворимы в липидах, чем в воде. Различия по ионизации. Белки имеют в своём составе радикалы лизина, аргинина, гистидина, глутаминовой и аспарагиновой кислот, содержащие функциональные группы, способные к ионизации (ионогенные группы). Кроме того, на N- и С-концах полипептидных цепей имеются α-амино- и α-карбоксильная группы, также способные к ионизации. Суммарный заряд белковой молекулы зависит от соотношения ионизированных анионных радикалов Глу и Асп и катионных радикалов Лиз, Apг и Гис. Значение рН, при котором белок приобретает суммарный нулевой заряд, называют " изоэлектрическая точка " и обозначают как pI. В изоэлектрической точке количество положительно и отрицательно заряженных групп белка одинаково, т.е. белок находится в изоэлектрическом состоянии. Так как большинство белков в клетке имеет в своём составе больше анионогенных групп (-СОО-), то изоэлектрическая точка этих белков лежит в слабокислой среде. Изоэлектрическая точка белков, в составе которых преобладают катионогенные группы, находится в щелочной среде. Наиболее яркий пример таких внутриклеточных белков, содержащих много аргинина и лизина, - гистоны, входящие в состав хроматина. Белки, имеющие суммарный положительный или отрицательный заряд, лучше растворимы, чем белки, находящиеся в изоэлектрической точке. Суммарный заряд увеличивает количество диполей воды, способных связываться с белковой молекулой, и препятствует контакту одноимённо заряженных молекул, в результате растворимость белков увеличивается. Заряженные белки могут двигаться в электрическом поле: анионные белки, имеющие отрицательный заряд, будут двигаться к положительно заряженному аноду (+), а катионные белки - к отрицательно заряженному катоду (-). Белки, находящиеся в изоэлектрическом состоянии, не перемещаются в электрическом поле.
Одной из самых старых и распространенных классификаций белков является классификация по форме молекулы. Она делит белки на 2 группы: глобулярные и фибриллярные. К глобулярным относят белки, соотношение продольной и поперечной осей которых не превышает 1:10, а чаще составляет 1:3 или 1:4, т.е. белковая молекула имеет форму эллипса. Большинство индивидуальных белков человека относят к глобулярным белкам. Они имеют компактную структуру и многие из них, за счёт удаления гидрофобных радикалов внутрь молекулы, хорошо растворимы в воде. Фибриллярные белки имеют вытянутую, нитевидную структуру, в которой соотношение продольной и поперечной осей составляет более 1:10. К фибриллярным белкам относят коллагены, эластин, кератин, выполняющие в организме человека структурную функцию, а также миозин, участвующий в мышечном сокращении, и фибрин - белок свёртывающей системы крови.
По химическому строению белки делят на простые и сложные. Белки, содержащие в своём составе только полипептидные цепи, состоящие из аминокислотных остатков, называют простые белки. Примером простых белков могут служить основные белки хроматина - гистоны; в их составе содержится много аминокислотных остатков лизина и аргинина, радикалы которых имеют положительный заряд. Однако очень многие белки, кроме полипептидных цепей, содержат в своём составе небелковую часть, присоединённую к белку слабыми или ковалентными связями. Небелковая часть может быть представлена ионами металлов, какими-либо органическими молекулами с низкой или высокой молекулярной массой. Такие белки называют сложные белки. Прочно связанная с белком небелковая часть носит название простетической группы. Простетическая группа может быть представлена веществами разной природы. Например, белки, соединённые с гемом, носят название гемопротеины.
7. Физико-химические свойства белков: растворимость, ионизация, гидратация, осаждение белков из растворов. Денатурация. Методы количественного измерения концентрации белков. Индивидуальные белки различаются по своим физико-химическим свойствам: форме молекул, молекулярной массе, суммарному заряду молекулы, соотношению полярных и неполярных групп на поверхности нативной молекулы белка, растворимости белков, а также степени устойчивости к воздействию денатурирующих агентов. Различия белков по молекулярной массе. Б елки - высокомолекулярные соединения, но могут сильно отличаться по молекулярной массе, которая колеблется от 6000 до 1 000 000 Да и выше. Молекулярная масса белка зависит от количества аминокислотных остатков в полипептидной цепи, а для олигомерных белков - и от количества входящих в него протомеров (или субъединиц). Различия белков по форме молекул. П о форме молекул белки делят на глобулярные и фибриллярные. Глобулярные белки имеют более компактную структуру, их гидрофобные радикалы в большинстве своём спрятаны в гидрофобное ядро, и они значительно лучше растворимы в жидкостях организма, чем фибриллярные белки (исключение составляют мембранные белки). Различия по р астворимости белков. Растворимость белков в воде зависит от формы, молекулярной массы, величины заряда, соотношения полярных и неполярных функциональных групп на поверхности белка. Кроме этого, растворимость белка определяется составом растворителя, т.е. наличием в растворе других растворённых веществ. Например, некоторые белки легче растворяются в слабом солевом растворе, чем в дистиллированной воде. С другой стороны, увеличение концентрации нейтральных солей может способствовать выпадению определённых белков в осадок. Денатурирующие агенты, присутствующие в растворе, также снижают растворимость белков. Различия по гидратации. На поверхности большинства внутриклеточных белков преобладают полярные радикалы, однако соотношение полярных и неполярных групп отлично для разных индивидуальных белков. Так, протомеры олигомерных белков в области контактов друг с другом часто содержат гидрофобные радикалы. Поверхности белков, функционирующих в составе мембран или прикрепляющиеся к ним в процессе функционирования, также обогащены гидрофобными радикалами. Такие белки лучше растворимы в липидах, чем в воде. Различия по ионизации. Белки имеют в своём составе радикалы лизина, аргинина, гистидина, глутаминовой и аспарагиновой кислот, содержащие функциональные группы, способные к ионизации (ионогенные группы). Кроме того, на N- и С-концах полипептидных цепей имеются α-амино- и α-карбоксильная группы, также способные к ионизации. Суммарный заряд белковой молекулы зависит от соотношения ионизированных анионных радикалов Глу и Асп и катионных радикалов Лиз, Apг и Гис. Значение рН, при котором белок приобретает суммарный нулевой заряд, называют " изоэлектрическая точка " и обозначают как pI. В изоэлектрической точке количество положительно и отрицательно заряженных групп белка одинаково, т.е. белок находится в изоэлектрическом состоянии. Так как большинство белков в клетке имеет в своём составе больше анионогенных групп (-СОО-), то изоэлектрическая точка этих белков лежит в слабокислой среде. Изоэлектрическая точка белков, в составе которых преобладают катионогенные группы, находится
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-18; просмотров: 359; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.58.68 (0.021 с.) |