
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лабораторно – практические работыСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
ЛАБОРАТОРНО – ПРАКТИЧЕСКИЕ РАБОТЫ ПО ДИСЦИПЛИНЕ «ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ КОРРОЗИИ И ПРОТИВОКОРРОЗИОННОЙ ЗАЩИТЫ»
Рекомендовано Методическим советом по качеству образовательной деятельности ДВГУПС в качестве методических указаний к проведению лабораторно-практических работ
Хабаровск Издательство ДВГУПС УДК 621.3-03(075.8) ББК 323я73 Б 241
Рецензенты:
Доктор технических наук, профессор, зав. кафедры «Литейное производство и технология металлов» ТОГУ главный специалист Института водных и экологических проблем,
Баранов, Е. М.
Методическое пособие соответствует ФГОС ВО по направлению подготовки баколавров и магистров по специальности «Нефтегазовое дело». Представлены теоретические сведения по физической химии коррозии, задания к выполнению практических работ и РГР, описание экспериментальной части и порядок выполнения лабораторных работ. предназначено для студентов 2- 4 курсов всех форм обучения, изучающих дисциплину «Физико-химические основы коррозии и противокоррозионной защиты».
УДК 621.3-03(075.8)
ВВЕДЕНИЕ
В инженерной практике специалистов нефтегазового хозяйства вопросы повышения коррозионной стойкости металлических и других материалов играют большую роль. Знание характеристик коррозии и областей применения коррозионно-стойких материалов является важнейшей составляющей технологического обеспечения и эксплуатации нефтяных и газовых комплексов. Без владения этими знаниями совершенно невозможно ориентироваться в вопросах эксплуатации, монтажа и ремонта трубопроводов, агрегатов и другого технологического оборудования. Обучение этим знаниям представляется совершенно необходимым моментом в подготовке специалистов. В данном методическом пособии изложены краткие теоретические сведения по физической химии коррозии, приведены задания к выполнению практических работ. Описана экспериментальная часть и порядок проведения лабораторных работ. Приведены контрольные вопросы. Лабораторно-практическая работа №1 Закономерности агрегатных превращений на примере испарения Теоретическая часть Физическая химия – наука о закономерностях химических процессов и явлений. Физическая химия изучает происходящие в любых системах изменения, сопровождающиеся переходом химической формы энергии в различные физические формы: тепловую, электрическую, лучистую и др. К главным задачам физической химии можно отнести изучение и объяснение основных закономерностей, определяющих направленность процессов, скорость их протекания, влияния на них среды, примесей, излучения и т.д., условия получения максимального выхода необходимых продуктов. Основными направлениями физической химии является изучение строения вещества и его свойств в различных агрегатных состояниях, химическая термодинамика, включая термохимию и учение о равновесиях, растворы, электрохимия, кинетика химических реакций. Физическая химия является теоретической основой для изучения физико-химических явлений и процессов, протекающих в земной коре, которые составляют предмет исследования геологии, минералогии, петрографии, геохимии, гидрохимии и других наук. Поэтому физико-химическая подготовка специалистов приобретает особо важное значение. Парообразование (испарение) жидкого вещества является одним из основных процессов фазовых переходов и характеризуется теплотой парообразования (испарения). Теплота парообразования ─ количество теплоты, которое необходимо сообщить определенному количеству вещества при постоянной температуре и давлении, чтобы перевести его из жидкого состояния в пар. Изучение фазовых переходов позволяет выявить взаимосвязь и взаимозависимость между такими параметрами как энтальпия (теплота) фазового перехода, давление, температура, а также получить зависимость давления насыщенного пара вещества от температуры и наоборот. Эти знания необходимы для определения физико-химических свойств веществ и материалов, а также для выполнения термодинамических и технологических расчетов для различных химических процессов. Экспериментальная часть
1. Определение теплоты парообразования легколетучей жидкости Цели работы: 1. Изучить зависимость давления насыщенного пара легколетучей жидкости от температуры. 2. Вычислить теплоту парообразования легколетучей жидкости на основании опытных данных графическим и аналитическим способом. 3. Рассчитать изменение энтропии в процессе испарения исследуемой жидкости.
Методика выполнения работы В открытом сосуде жидкость закипает, когда давление насыщенного пара становится равным атмосферному давлению. Если откачать частично воздух из закрытого сосуда, содержащего жидкость, то наблюдается понижение температуры кипения до такого уровня, при котором давление насыщенного пара равно давлению воздуха внутри сосуда. На этом принципе основан один из методов определения давления насыщенного пара исследуемой жидкости. Сущность метода заключается в том, что экспериментатор фиксирует температуры кипения жидкости при разных давлениях. Величина давления внутри сосуда (системы) определяется с помощью вакуумметра. Измерения целесообразно проводить, переходя от максимального разрежения к минимальному разрежению в системе. Перед началом работы необходимо проверить наличие жидкости и капилляров в сосуде 1. Включить электроплитку, поставить на неѐ стакан с водой для нагревания. Первым этапом работы является проверка герметичности системы. Для этого кран 7 ставят в такое положение, при котором установка сообщается с насосом Комовского. При помощи насоса в системе создают максимальное разрежение, чтобы стрелка вакуумметра занимала положение в пределах от 0,9 до 1,0. После этого кран 7 закрывают и тем самым изолируют систему от насоса и внешней среды. В течение 5─10 минут проверяют герметичность системы. Если в течение этого времени стрелка вакуумметра не изменит своего положения, то считают, что герметичность системы обеспечена. На втором этапе работы задают разрежение в системе такое, чтобы вакуумметр показывал значение в пределах от 0,95 до 1,0. К этому моменту времени вода в стакане должна нагреться. В стакан с нагретой водой опускают сосуд 1 с исследуемой жидкостью. Как только жидкость в сосуде закипит, отмечают температуру кипения и показания вакуумметра (в системе устанавливается равновесие, т.е. температура кипения и показания вакуумметра примут постоянные значения). Отсчеты температуры кипения и показания вакуумметра должны относиться к одному и тому же моменту времени. Затем сосуд 1 поднимают из стакана с водой для того, чтобы прекратить кипение и испарение исследуемой жидкости из сосуда. После первого определения температуры кипения жидкости давление в системе увеличивают примерно на 0,1 деления вакуумметра путем осторожного перевода крана 7 на короткий промежуток времени в положение, при котором в систему поступает воздух. Другим способом является создание нового давления с помощью насоса Комовского после полного открытия крана 7. Вновь определяют температуру кипения при новом давлении. Измерения повторяют до тех пор, пока давление в сосуде не достигнет атмосферного (положение стрелки вакуумметра на 0). Необходимо провести 8─10 таких измерений при разных значениях α (от 0,95 до 0). Все результаты измерений сводят в таблицу 1.1. Таблица 1.1 Экспериментальные данные и результаты их обработки
В таблице 1.1 использованы следующие обозначения: α ─ показания стрелки вакуумметра; ─ давление насыщенного пара исследуемой жидкости в системе при данной температуре; ─ барометрическое (внешнее атмосферное) давление, которое определяют по барометру в препараторской комнате (например, 740 мм.рт.ст);. Давления и могут быть выражены в мм рт.ст. или в Па. Для перевода одних единиц в другие учитывают, что: 1 атм. = 760 мм. рт. ст =1,013 ∙ Давление насыщенного пара исследуемой жидкости рассчитывается по формуле: Например, если барометрическое давление = 740 мм.рт.ст., а показания стрелки вакуумметра α = 0,5, то: = 740 · (1 - 0,5) = 370 мм.рт.ст. На основании полученных экспериментальных данных необходимо сделать следующее: 1) построить график зависимости давления паров исследуемой жидкости от температуры 2) построить график зависимости; 3) вычислить теплоту парообразования жидкости графическим методом, используя уравнение (1.19); 4) вычислить теплоту парообразования аналитическим способом по уравнению Клапейрона – Клаузиуса. 5) сравнить полученную двумя способами теплоту парообразования со справочным еѐ значением при стандартных условиях (см. табл. 1.2); 6) рассчитать изменение энтропии в процессе испарения 1 моль исследуемой жидкости при температуре кипения при атмосферном давлении и сравнить еѐ с табличным значением при стандартных условиях (см. табл. 1.2); 7) проанализировать полученные результаты и сделать выводы по работе.
Таблица 1.2 Термодинамические свойства веществ
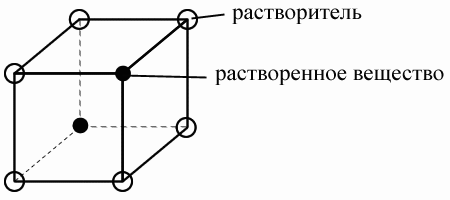
Теоретическая часть Сплав – вещество, содержащее в своем составе два или более компонентов, по крайней мере один из которых – металл. Компонент – химическое вещество, входящее в состав сплава. В дальнейшем будем рассматривать двойные сплавы. Различные типы кристаллических сплавов. 1. Твердые растворы – кристаллы, у которых один из компонентов образует собственную кристаллическую решетку, а второй присутствует в виде отдельных атомов, то есть собственной кристаллической решетки не имеет. Первый компонент называют растворителем, а второй – растворенным компонентом. Выделяют твердые растворы внедрения и твердые растворы замещения. В твердых растворах внедрения – атомы растворенного вещества находятся в межатомных промежутках растворителя.
Особенности: – растворенные вещества должны иметь малый атомный радиус (обычно это неметалл); – ограниченная растворимость; В твердых растворах замещения – атомы растворенного вещества замещают атомы растворителя в узлах кристаллической решетки.
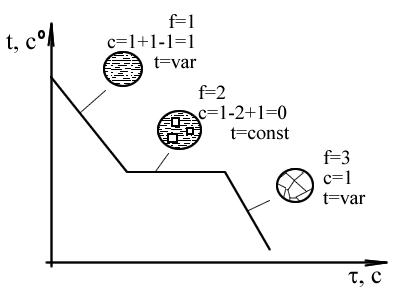
Особенности – растворенное вещество такого же типа, как и растворитель (атомы близки по размеру); – часто имеют неограниченную растворимость; 2. Химические соединения. Кристаллы, в структурах которых атомы двух компонентов образуют химическую связь. Особенности: – сложная кристаллическая решетка, в которой оба компонента занимают строгоопределенные места; – постоянный химический состав (стехиометрический) металл-неметалл; 3. Интерметаллидные соединения – химические соединения между двумя металлами. МеnМеm. Особенности: – постоянный состав; – способность образовывать твердые растворы (внедрения); Правило Гиббса. Фаза – часть объема вещества, ограниченная поверхностью раздела, при переходе через которую скачком меняется структура, химический состав, свойства вещества. Изменение фазового состава вещества возможно при изменении следующих термодинамических параметров: 1. Химический состав. 2. Давление. 3. Температура. или всех трех вместе. В дальнейшем будем считать, что: – химический состав сплава в целом остается неизменным; – все процессы происходят при постоянном давлении; – изменение фазового состава связано с изменением температуры; Число степеней свободы – количество термодинамических параметров, при изменении которых фазовый состав вещества остается неизменным. Правило Гиббса устанавливает связь между числом компонентов, числом степеней свободы и количеством фаз в системе. c = k – f +1 c – число степеней свободы; k – число компонентов; f – количество фаз; С помощью правила Гиббса можно узнать количество степеней свободы: с = 1 (для данного процесса температура может меняться), или с = 0 (температура остается неизменной).
Так как в наших условиях k = 2, а число термодинамических параметров, которые могут изменяться = 1, то с помощью правила Гиббса для каждого процесса фазового перехода можно определить (в сплавах), происходит ли этот процесс при постоянной температуре, или при переменной. Применение правила Гиббса. 1. Кристаллизация чистого вещества (k = 1). Чистые вещества кристаллизуются при постоянной температуре.
2. Кристаллизация сплава двух компонентов, неограниченно растворимых друг в друге в твердом состоянии (k = 2). Во время процесса изменяется число фаз.
1) Охлаждение идет с довольно большой скоростью. 2) Начинается процесс кристаллизации. Скорость охлаждения падает. Уменьшается температура (кристаллизация идет при падении температуры). 3) Скорость охлаждения снова увеличивается. Сплавы компонентов, неограниченно растворимых друг в друге в твердом состоянии кристаллизуются при переменной температуре, то есть в диапазоне температур. В этом диапазоне при каждой фиксированной температуре весовое соотношение жидкости и твердого вещества строго определенное. 3. Кристаллизация сплава компонентов не растворимых друг в друге в твердом состоянии. Атомные параметры элементов не совместимы.
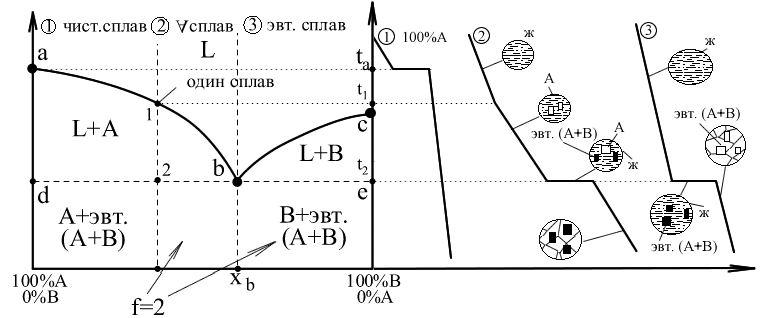
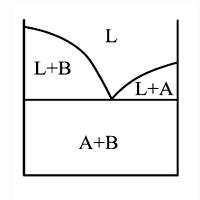
Кристаллизация идет в два этапа: – кристаллизация чистых кристаллов одного из компонентов (А) происходит при переменной температуре. Химический состав оставшейся жидкости меняется (изменяется процентное содержание А в жидкости). – Одновременная кристаллизация компонентов А+В происходит при постоянной температуре. Образование смеси А+В происходит при строго определенном соотношении между компонентами А и В в незакристаллировавшейся жидкости. Эвтектическая смесь – легкоплавкая смесь. Температура, при которой происходит образование такой смеси называется температурой эвтектического превращения. Температура и химический состав эвтектики являются постоянными для каждой пары веществ. Диаграммы состояния. Рассматриваются только бинарные сплавы. Диаграмма состояния – график, описывающий изменение структурного и фазового состава сплава при изменении температуры. Диаграммы состояния строятся в координатах температура – химический состав. Все диаграммы строятся экспериментально. Существует несколько основных типов диаграмм состояния бинарных сплавов металлов: Диаграммы II рода. Компоненты не растворимы друг в друге в твердом состоянии.
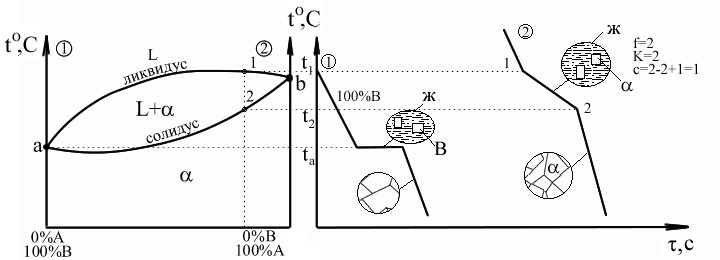
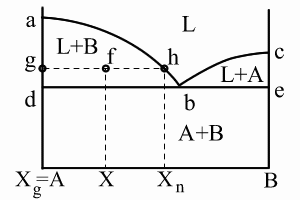
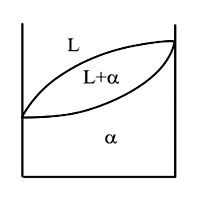
Основные линии диаграммы: abc – линия ликвидус – геометрическое место точек начала кристаллизации сплавов различного химического состава: Выше этой линии все сплавы находятся в жидком состоянии. L – liquid. dbe – линия солидус – геометрическое место точек конца процесса кристаллизации; Ниже этой линии все сплавы находятся в твердом состоянии. abd и bce – двухфазное состояние сплавов – происходит процесс кристаллизации. Точка b – точка эвтектики; xb – эвтектический состав для данной пары компонентов. Анализ превращений на диаграмме состояния каждого сплава необходимо вести вдоль вертикальной линии, проходящей через точку на оси химического состава, определяющую суммарный химический состав сплава. То есть состав сплава определяется точкой на диаграмме с координатами температура–химический состав.Структура и фазовый состав будет определяться областью, в которую попадет эта точка. Сплав (3) – эвтектический сплав, включающий в себя оба компонента; кристаллизуется аналогично чистым компонентам при постоянной температуре. Диаграммы I рода. Компоненты неограниченно растворимы друг в друге в твердом состоянии.
Компоненты имеют близкие атомные параметры и кристаллические решетки. Диаграммы II рода. Компоненты ограниченно растворимы друг в друге.
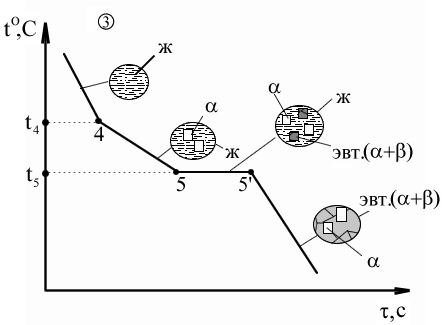
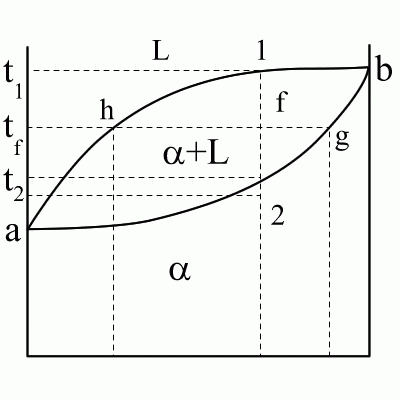
abc – линия ликвидус; Xb – химический состав эвтектики. adec – линия солидус. df, eg – линии предельной растворимости в твердом состоянии. Сплав (1): Выше t1 – охлаждение с высокой скоростью, зависящее от внешних условий. 1-2 – первичная кристаллизация, образование твердого раствора. Вследствие низкого содержания компонента А в исходном сплаве при достижении t2 весь компонент А расходуется на образование -кристаллов, следовательно в точке 2 – однофазный твердый сплав. 2-3 – остывание сплава; превращений нет. Ниже температуры t3 – точка 3 соответствует достижению -кристаллического состояния насыщенности, дальнейшее понижение температуры приводит к выделению избыточного компонента А за счет диффузии в небольшие зоны на границе кристаллов. Эти зоны превращаются в мелкие кристаллы, то есть происходит вторичная кристаллизация внутри твердой фазы. Сплав (2): Процесс аналогичен образованию эвтектики, толь ко вместо чистых компонентов А и В -твердые растворы. Сплав (3): Выше температуры t4 – охлаждение сплава – превращений нет. t4 – t5 – первичная кристаллизация -кристаллов, при этом содержание компонента А в жидкости уменьшается и состав жидкости постепенно приближается к эвтектическому (при t5). 5–5' – состав жидкости соответствует эвтектическому, идет образование эвтектики (температура постоянна). Температура ниже t5 – охлаждение сплава, вторичная кристаллизация с образованием -вторичных кристаллов. Для заэвтектической области процессы и кривые охлаждения сплавов аналогичны, только и -кристаллы меняются местами. Диаграммы III рода. Компоненты образуют в твердом состоянии химические соединения.
Диаграммы для компонентов, образующих химические соединения, определяются числом возможных химических соединений, и представляют собой совокупность диаграмм различного типа 1, 2 или 3. В каждой из этих диаграмм чистые компоненты и соответствующие химические соединения могут играть роль как чистых компонентов, так и основы для твердых растворов. Это определяется физическими свойствами компонентов и их соединений. Важно, что на графике диаграммы надо обеспечить стыковку на важнейших точках линии ликвидус и солидус (должна получиться одна общая линия). Правило отрезков. Правило отрезков применяется для двухфазных областей диаграммы. С помощью правила отрезков можно для сплавов постоянного химического составаопределить при изменении температуры: 1. Весовое соотношение между фазами. 2. Изменение химического состава фаз. Правило отрезков для диаграмм II рода.
Для линий abd, bce и части диаграммы ниже линии de можно применить правило отрезков. Выберем сплав определенного химического состава x и рассмотрим применение правила отрезков для этого сплава при температуре t1. Общее состояние сплава определяется точкой f. Правило отрезков позволяет определить относительное количество фаз. 1) Фазы L+B: 2) Химический состав фаз: Относительное количество фаз определяется отношением соответствующей части горизонтального отрезка, проведенного для заданной температуры t1 – до пересечения с границами области к общей длине этого отрезка. Химический состав фаз при заданной температуре определяется проекцией точек пересечения горизонтального отрезка с заданными границами областей на ось химического состава. Правило отрезков для диаграмм I рода.
Для a1b2 работает правило отрезков: Химический состав фаз для рассматриваемой области определяется проекциями точек, попадающих на границу с областью, занимаемой соответствующей фазой, то есть в донном случае точка g на границе с областью Применим правило отрезков для точек 1, f и 2 сплава x. При этом химический состав образующихся Это противоречие связано с тем, что рассматриваемая нами диаграмма состояния является равновесной, то есть: а) Процесс фазового превращения происходит бесконечно медленно; б) Происходит диффузионное выравнивание химических составов каждой фазы; В действительности: а) Скорость кристаллизации конечна; б) Полного выравнивания химического состава твердой фазы не происходит, то есть в составе образовавшейся твердой структуры остаются Ликвация – процесс, при котором часть структуры сплава отличается по своему химическому строению от основного состава. В реальных сплавах всегда происходит процесс ликвации. Правило отрезков для диаграмм II рода с твердыми растворами.
Применим правило отрезков для линий adf, fdeg и ceg. Для сплава состава x при температуре ti (точка i). Две фазы: жидкость и -кристаллы: Для сплава x при температуре tl (точка l). Две фазы и : Для двухфазной области fdeg правило отрезков также работает. Изменение относительного количества и химического состава в этой области происходит за счет изменения растворимости компонентов друг в друге и соответствующих диффузионных процессов перераспределений внутри сплавов. Диаграммы. Состав. Свойства. Диаграмма Курнакова. Курнаков установил, что между типом диаграммы сплава и изменением его свойств при изменении состояния имеется соответствие. В его основе: 1) Изменение физических свойств твердых растворов существенно нелинейно зависит от их химического состава. 2) Изменение свойств механических смесей линейно связано с изменением относительного количества кристаллов в смеси.
Эта связь позволяет: 1) При исследовании новых сплавов и определении их свойств существенно сократить объем исследований, так как характеристика соответствующего графика известна. 2) На основе характеристик изменения свойств сплава уточнить соответствующие структуры превращения в нем. ЗАДАНИЯ НА ВЫПОЛНЕНИЕ РГР 1.Для заданной преподавателем двойной диаграммы и заданного масс.% второго компонента построить термограмму и объяснить процессы кристаллизации при охлаждении. План коллоквиума по теме «Фазовое равновесие»
1. Основные понятия и примеры: система гомогенная и гетерогенная; фаза, компонент, число независимых компонентов, число степеней свободы. 2. Правило фаз Гиббса и его применение. 3. Термический анализ, сущность и значение. Построение диаграмм состояния по кривым охлаждения. 4. Полный анализ диаграммы состояния двухкомпонентных систем:
а) фазовая диаграмма с простой эвтектикой; б) фазовая диаграмма с образованием устойчивого химического соединения (конгруэнтно плавящимся); в) фазовая диаграмма с образованием неустойчивого химического соединения (инконгруэнтно плавящимся); г) фазовая диаграмма с неограниченной взаимной растворимостью компонентов в твердом состоянии; д) фазовая диаграмма с ограниченной растворимостью компонен-тов в твердом состоянии (I и II вида); е) фазовая диаграмма с полиморфизмом компонентов. 5. Правило рычага и его применение.
Теоретическая часть Экспериментальная часть Термогравиметрический анализатор (дериватограф) TGA/DSC1 Начало формы Конец формы
ЗАДАНИЯ К РГР Задание 1
Рассчитать отрицательный и положительный массовый
Задание 2
Оценить сплошность пленок, образуемых на поверхности металлов при высокотемпературной коррозии по данным таблицы.
Задание 3
В табл. приведены упругости диссоциации Р МеО оксидов двух металлов. Будут ли корродировать эти металлы: а) на воздухе; б) в вакууме, давление воздуха в котором равно 10-3 Па? Температура 1000 °С. Ответ обоснуйте.
Задание 4
Оцените возможность использования металла для жаростойкого легирования железа по данным таблицы 3.5.(сравнительную оценку выполните по отношению к железу). Ответ обоснуйте.
Примечания: * – радиус иона металла; ** – работа образования оксида; Потенциометрия Теоретическая часть Растворы электролитов Различают две основные группы проводников электрического тока: проводники первого рода, электрическая проводимость которых обусловлена электронами; проводники второго рода, обладающие ионной проводимостью. Вещества, проводящие электрический ток своими ионами, называются электролитами. Согласно теории Аррениуса электролиты при растворении диссоциируют на положительно (катионы) и отрицательно (анионы) заряженные ионы. Причина электролитической диссоциации заключается во взаимодействии молекул растворяемого вещества и растворителя. Электролиты при растворении могут диссоциировать на ионы полностью или частично. Для характеристики полноты диссоциации электролита Аррениус ввел понятие степени диссоциации ( Все электролиты условно разделяют на сильные и слабые. Сильные электролиты в растворах диссоциируют практически нацело ( Слабые электролиты — вещества с преимущественно ковалентными связями (большинство органических веществ - CH3COOH, пиридин, некоторые неорганические кислоты и основания – H2CO3, H3PO4, H2S, NH4OH и др.). Слабые электролиты диссоциируют частично и в растворе устанавливается динамическое равновесие между ионами и недиссоциированными молекулами. Электролиты – химические соединения полностью либо частично диссоциирующие на ионы в растворе.
Константа диссоциации слабого электролита К равновесию, которое устанавливается в растворе слабого электролита между ионами и молекулами, можно применить законы химического равновесия и записать выражение для константы равновесия. Например, для диссоциации типичного слабого электролита уксусной кислоты константа равновесия, выраженная через молярные концентрации
Константа равновесия процесса диссоциации слабого электролита называется константой диссоциации природы электролита и растворителя, а также от температуры, и характеризует способность данного электролита распадаться на ионы в растворе. Чем больше электролит в растворе. Многоосновные кислоты и основания диссоциируют ступенчато, каждая из ступеней характеризуется своей константой диссоциации. Для одновалентного электролита связь между константой и степенью диссоциации электролита выражает закон разбавления Освальда:
где
Электрическая проводимость растворов электролитов Электрическая проводимость проводить электрический ток под действием внешнего электрического поля. По физическому смыслу электрическая проводимость обратна сопротивлению
где: проводника, Различают удельную и молярную
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-14; просмотров: 555; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.147.146 (0.02 с.) |


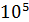 Па.
Па. ;
; H, кДж/моль 298K
H, кДж/моль 298K

 (ж)
(ж)

 (ж)
(ж)





 – твердый раствор компонентов А и В друг в друге. Для разных веществ химический состав кристаллов будет разный. Кристаллы в ходе кристаллизации имеют разный химический состав между точками (1) и (2). Диаграммы такого типа имеют компоненты близкие по атомным параметрам и по типу кристаллической решетки.
– твердый раствор компонентов А и В друг в друге. Для разных веществ химический состав кристаллов будет разный. Кристаллы в ходе кристаллизации имеют разный химический состав между точками (1) и (2). Диаграммы такого типа имеют компоненты близкие по атомным параметрам и по типу кристаллической решетки.


 – ограниченный твердый раствор компонента B в компоненте А.
– ограниченный твердый раствор компонента B в компоненте А.

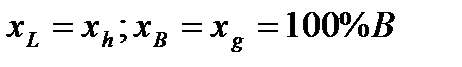
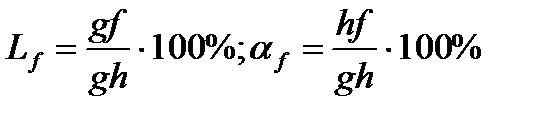 ;
; 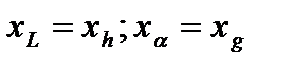

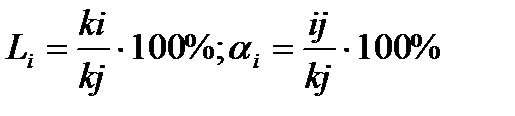 ;
;  .
. ;
; 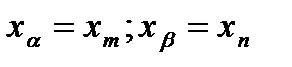 .
.




 , глубинный Kп, и объемный Кv показателикоррозии металлов по данным
, глубинный Kп, и объемный Кv показателикоррозии металлов по данным 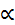 ): отношение числа молекул электролита, распавшихся в растворе на ионы, к первоначальному числу его молекул в растворе. Степень диссоциации электролита в растворе зависит от его природы, концентрации, природы растворителя, температуры и присутствия посторонних электролитов.
): отношение числа молекул электролита, распавшихся в растворе на ионы, к первоначальному числу его молекул в растворе. Степень диссоциации электролита в растворе зависит от его природы, концентрации, природы растворителя, температуры и присутствия посторонних электролитов. 1). К ним относятся вещества, у которых межчастичные связи преимущественно электростатические (соли, сильные кислоты и основания HCl, HNO3, H2SO4, NaOH, KOH, NaCl, K2SO4 и др.).
1). К ним относятся вещества, у которых межчастичные связи преимущественно электростатические (соли, сильные кислоты и основания HCl, HNO3, H2SO4, NaOH, KOH, NaCl, K2SO4 и др.).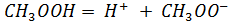
 ; (4.1)
; (4.1) . Эта величина зависит от
. Эта величина зависит от ; (4.2)
; (4.2) - молярная концентрация электролита, моль/л.
- молярная концентрация электролита, моль/л. это способность вещества
это способность вещества :
: ; (4.3)
; (4.3) - удельное сопротивление, Ом м;
- удельное сопротивление, Ом м;  – поперечное сечение
– поперечное сечение ;
;  - длина проводника, м.
- длина проводника, м.


