
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дериватография – измерение веса образца в реальном режиме времени (гравиметрия) с одновременным проведением дифференциально-термического анализа дта.Содержание книги
Поиск на нашем сайте Принципы дериватографии:
1. Гравиметрия производится с помощью коромысла, на одной чаше которого установлен исследуемый образец материала. Вторая чаша коромысла притягивается электрическим магнитом с тарируемым усилием. Усилие прямо пропорционально силе тока в катушке магнита. 2. Сигнал ДТА снимается с двух термопар, подключенных компенсационным образом, спай одной из которых погружен в исследуемое вещество, а второй спай погружен в вещество, в котором заведомо не происходят никакие превращения (инертная среда). 3. Площадь под кривой ДТА прямо-пропорциональна тепловому эффекту превращения. Гравиметрия – наиболее точный инструмент гетерофазной кинетики, позволяющий определить все коэффициенты коррозии. ДТА позволяет оценить сродство исследуемого металла к кислороду или другому коррозионно-активному агенту. Химическая коррозия металлов – это самопроизвольное взаимодействие металла с коррозионной средой, при котором окисление металла и восстановление окислительного компонента коррозионной среды протекают в одном акте. Химическая коррозия возникает в результате химического воздействия коррозионной среды (без образования электрического тока) и протекает обычно в неэлектропроводной среде, например, в безводных средах и газах, особенно при повышенных температурах. При химической коррозии окисление двухвалентного металла происходит с образованием оксидных соединений по следующей схеме: 2Ме + О2 ® 2МеО. (3.1) Частным случаем химической коррозии является газовая, которая протекает в газах при высокой температуре. Первопричина химической коррозии – высокое сродство к кислороду многих металлов при недостаточной пассивирующей способности их оксидов. При решении вопроса о термодинамической возможности газовой коррозии необходимо рассчитатьизменение свободной энергии во время реакции окисления илисравнить внешнее парциальное давление окислителя и упругость диссоциации продуктов коррозии металлов (оксидов). Принципиальная возможность протекания реакции окисления металла определяется изобарно-изотермическим потенциалом D Gт (энергией Гиббса). Если D Gт < 0, то коррозия возможна; D Gт > 0 – коррозия невозможна; D Gт = 0 – имеет место равновесие реакции. Чтобы определить D Gт, нужно произвести расчёт по формуле: D Gт = RT (lg РМеО – lg где Р МеО – равновесное парциальное давление кислорода, или упругость диссоциации оксида; Реакция окисления будет протекать в том случае, когда парциальное давление окислителя в смеси газов будет больше упругости диссоциации оксида этого металла, т.е. Кинетика– наука о скорости протекания химических процессов. Необходимо запомнить, что основными кинетическими показателями коррозии металлов являются массовый показатель скорости коррозии Массовый показатель
Этот показатель может быть отрицательным, если масса металла за время испытания t после удаления продуктов коррозии уменьшилась Если известен состав продуктов коррозии металла, то можно сделать пересчет положительного показателя изменения массы в отрицательный по формуле:
где А ме – атомная масса металла; А ок – атомная масса окислителя; Глубинный показатель Кп, мм/год, связан с массовым отрицательным
где Объемный показатель коррозии определяется по формуле:
где V 0 – приведенный к нормальным условиям объем поглощенного газа, м3, и определяется по формуле:
где Т – температура окисления, К. Во время высокотемпературного окисления из внешней среды поглощается кислород. Поэтому по изменению объема поглощенного кислорода можно рассчитать массу D m прокорродировавшего при этом металла, используя обычные стехиометрические расчеты. Пример. При высокотемпературной коррозии цинка на воздухе в течение 5 часов поглотилось 200 см3 кислорода при 400 оС и нормальном давлении. Площадь изделия составляла 100 см2. Определить показатели скорости коррозии: Поскольку объем кислорода V t в ходе опыта дан при температуре 400 оС, то его необходимо привести к нормальным условиям. Для этого целесообразно использовать следующую формулу:
Объемный показатель коррозии определяем по формуле:
Высокотемпературное окисление цинка происходит по реакции: 2Zn + O2 =2ZnO. В соответствии с реакцией при высокотемпературном окислении двух грамм-атомов цинкарасходуется один грамм-моль кислорода,или
Определяем массовый отрицательный показатель скорости коррозии.
Определяем глубинный показатель скорости коррозии
Если по условиям эксплуатации металлического изделия дано положительное изменение массы металла (образовавшийся оксид формирует пленку на поверхности металла), то указанное число может быть использовано для расчета соответствующего положительного массового показателя. Для определения массы прореагировавшего металла (убыли массы) и объема поглощенного при окислении кислорода необходимо использовать стехиометрические соотношения реакции окисления. При окислении на поверхности металла образуются плёнки, которые снижают его химическую активность. Оксидные плёнки могут быть сплошные либо несплошные. Сплошность образуемой на металле
где V ок – молекулярный объём оксида; V ме – атомный объём металла. Соотношение условия сплошности можно рассчитать по формуле:
где М ок – молекулярная масса оксида; rме – плотность металла; Если полученное расчетное значение Необходимо обратить внимание на внутренние и внешние факторы газовой коррозии, защитные атмосферы, применяющиеся при нагреве изделий. Приизучении теорий жаростойкого легирования необходимо усвоитьи уметь применять критерии, которыми руководствуются при выборелегирующего металла для защиты железа от высокотемпературной коррозии. Согласно этим теориям к легирующим элементам можно предъявить следующие обобщенные требования: 1) ионы легирующего компонента входят в решётку оксида основного металла, уменьшая его дефектность. Это можно достичь путем применения металлов, радиус ионов которых меньше радиуса иона железа: r*и < rи; (3.10) 2) легирующий компонент образует на поверхности свой защитный оксид, препятствующий окислению основного металла. Это достигается путем введения металлов, сродство к кислороду у которых выше, чем у железа, при этом оксид легирующего металла образуется быстрее. (D Gт)Ме* m Оmn /2 < (D Gт)Ме m Оmn /2, где (D Gт)Ме* m Оmn /2 – сродство к кислороду легирующего элемента; 3) оксид легирующего элемента должен обладать защитными свойствами, т.е. удовлетворять условию сплошности; 4) легирующий элемент должен образовывать оксид с высоким электрическим сопротивлением; 5) легирующий компонент с основным металлом образует двойные оксиды типа шпинели, обладающие повышенными защитными свойствами; 6) оксид легирующего компонента должен растворяться в основном металле; 7) легирующий элемент должен образовывать оксид с высокой температурой плавления и возгонки.
Контрольные вопросы
1. Что означает термин «коррозия металлов»? 2. Каковы особенности протекания процесса коррозии? 3. Как различаются виды коррозии помеханизму процесса? 4. Как классифицируются коррозионные процессы по видупоражения и условиям протекания коррозионных процессов? 5. Что называют химической коррозией? 6. Каково термодинамическое условие протекания химической коррозии? 7. Какие требования предъявляют к защитным пленкам, образующимся при газовой коррозии? 8. Каков механизм роста пленок? Законы роста пленок. 9. Как влияет температура на скорость газовой коррозии? 10. Как зависит скорость газовой коррозии стали от ее состава, внутренних напряжений и деформации? 11. Каковы основные положения теорий жаростойкого легирования сталей? 12. Какие защитные атмосферы применяют при термообработке стали? 13. Как можно уменьшить окалинообразование на стали при термической обработке?
Экспериментальная часть Термогравиметрический анализатор (дериватограф) TGA/DSC1 Начало формы Конец формы
|
||
|
Последнее изменение этой страницы: 2016-12-14; просмотров: 772; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.009 с.) |

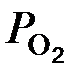 ); (3.2)
); (3.2) – фактическое парциальное давление кислорода в смеси газов.
– фактическое парциальное давление кислорода в смеси газов.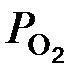 > Р МеО. Реакция высокотемпературного окисления металла будет находиться в равновесии, если парциальное давление кислорода
> Р МеО. Реакция высокотемпературного окисления металла будет находиться в равновесии, если парциальное давление кислорода  , глубинный показатель Кп и объемный Кv.
, глубинный показатель Кп и объемный Кv. (3.3).
(3.3).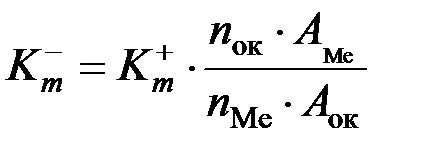 ; (3.4)
; (3.4)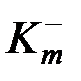 и
и 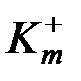 – соответственно отрицательный и положительный массовый показатель коррозии.
– соответственно отрицательный и положительный массовый показатель коррозии. ; (3.5)
; (3.5) ; (3.6)
; (3.6) ; (3.7)
; (3.7) ,
,  м3.
м3.
 м3/м2×ч.
м3/м2×ч.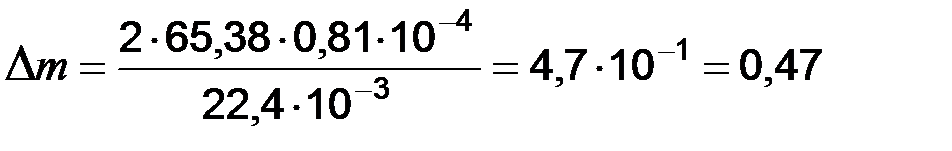 г.
г. г/м2×ч.
г/м2×ч. мм/год.
мм/год. ; (3.8)
; (3.8) ; (3.9)
; (3.9) или
или  , то образованная оксидная пленка не является сплошной. Отношение удельного объема оксида к удельному объему исследуемого металла называется критерием Пиллинга–Бэдворта.
, то образованная оксидная пленка не является сплошной. Отношение удельного объема оксида к удельному объему исследуемого металла называется критерием Пиллинга–Бэдворта.


