
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Данные для расчета показателей скорости коррозии
Задание 2
Оценить сплошность пленок, образуемых на поверхности металлов при высокотемпературной коррозии по данным таблицы.
Данные для расчета условия сплошности пленок
Задание 3
В табл. приведены упругости диссоциации Р МеО оксидов двух металлов. Будут ли корродировать эти металлы: а) на воздухе; б) в вакууме, давление воздуха в котором равно 10-3 Па? Температура 1000 °С. Ответ обоснуйте.
Данные для расчета вероятности протекания газовой коррозии
Задание 4
Оцените возможность использования металла для жаростойкого легирования железа по данным таблицы 3.5.(сравнительную оценку выполните по отношению к железу). Ответ обоснуйте.
Примечания: * – радиус иона металла; ** – работа образования оксида; Лабораторно-практическая работа №4 Потенциометрия Теоретическая часть Растворы электролитов Различают две основные группы проводников электрического тока: проводники первого рода, электрическая проводимость которых обусловлена электронами; проводники второго рода, обладающие ионной проводимостью. Вещества, проводящие электрический ток своими ионами, называются электролитами. Согласно теории Аррениуса электролиты при растворении диссоциируют на положительно (катионы) и отрицательно (анионы) заряженные ионы. Причина электролитической диссоциации заключается во взаимодействии молекул растворяемого вещества и растворителя. Электролиты при растворении могут диссоциировать на ионы полностью или частично. Для характеристики полноты диссоциации электролита Аррениус ввел понятие степени диссоциации ( Все электролиты условно разделяют на сильные и слабые. Сильные электролиты в растворах диссоциируют практически нацело ( Слабые электролиты — вещества с преимущественно ковалентными связями (большинство органических веществ - CH3COOH, пиридин, некоторые неорганические кислоты и основания – H2CO3, H3PO4, H2S, NH4OH и др.). Слабые электролиты диссоциируют частично и в растворе устанавливается динамическое равновесие между ионами и недиссоциированными молекулами. Электролиты – химические соединения полностью либо частично диссоциирующие на ионы в растворе.
Константа диссоциации слабого электролита К равновесию, которое устанавливается в растворе слабого электролита между ионами и молекулами, можно применить законы химического равновесия и записать выражение для константы равновесия. Например, для диссоциации типичного слабого электролита уксусной кислоты константа равновесия, выраженная через молярные концентрации
Константа равновесия процесса диссоциации слабого электролита
называется константой диссоциации природы электролита и растворителя, а также от температуры, и характеризует способность данного электролита распадаться на ионы в растворе. Чем больше электролит в растворе. Многоосновные кислоты и основания диссоциируют ступенчато, каждая из ступеней характеризуется своей константой диссоциации. Для одновалентного электролита связь между константой и степенью диссоциации электролита выражает закон разбавления Освальда:
где
Электрическая проводимость растворов электролитов Электрическая проводимость проводить электрический ток под действием внешнего электрического поля. По физическому смыслу электрическая проводимость обратна сопротивлению
где: проводника, Различают удельную и молярную электрические проводимости растворов электролитов. Удельная электрическая проводимость раствора электролита между двумя параллельными электродами площадью 1 женными на расстоянии 1 м друг от друга. Удельная электрическая проводимость является величиной, обратной удельному сопротивлению.
Единицей измерения удельной электрической проводимости является 1/Ом м. В электрохимии часто пользуются традиционным определением удельной электрической проводимости: это проводимость столбика вещества длиной 1 см и с сечением 1 =1/Ом см.
Рис. 4.1. Зависимость удельной электрической проводимости сильных и слабых электролитов от концентрации раствора.
Удельная электрическая проводимость электролитов определяется количеством и зарядом ионов, переносящих электричество, а также скоростью их движения в электрическом поле. График зависимости электролитов представляет собой кривую с четко выраженным максимумом, а для слабых — этот максимум в значительной степени размыт и практически не проявляется (рис. 4.1). В области малых концентраций растворов сильных и слабых электролитов рост электрической проводимости обусловлен
увеличением количества ионов — переносчиков электричества. При увеличении концентрации растет плотность раствора, что снижает скорость движения ионов, при этом у слабых электролитов заметно снижается степень диссоциации, поэтому слабых электролитов начинает уменьшаться в области значительно более разбавленных растворов и роста электропроводности практически не наблюдается, а максимум на кривой получается очень пологим. Повышение температуры на 1 К увеличивает удельную электропроводность на 2–2,5 % за счет понижения вязкости раствора и уплотнения гидратированных ионов, а для растворов слабых электролитов — за счет увеличения степени диссоциации в случае эндотермической реакции растворения электролита. На величину удельной электрической проводимости, кроме перечисленных факторов, влияет валентность (заряд) иона: чем больше заряд иона, тем большее количество электричества он переносит. Так, двухвалентный анион отдает аноду два электрона, в то время как одновалентный — только один. Давление не оказывает заметного влияния на удельную электрическую проводимость. Таким образом, удельная электрическая проводимость зависит от многих факторов, но, как это следует из определения, она не относится к определенному количеству вещества (концентрация раствора между электродами, находящимися на расстоянии 1 м не оговорена и может быть любой). В связи с этим в электрохимии введено понятие молярной электрической проводимости раствора электролита. В более ранних изданиях учебной литературы этот тип электрической проводимости называется эквивалентной. Молярная электрическая проводимость 1/Ом·м моль. Удельная и молярная электрические проводимости связаны между собой соотношением:
где С - молярная концентрация растворенного вещества, моль/л; удельная электрическая проводимость, 1/Ом м. Зависимость от скорости движения для одновалентных ионов выражается уравнением:
Где V- абсолютные скорости движения положительных и отрицательных ионов соответственно, F- число Фарадея. Для сильных электролитов можно принять
Произведения F V
Для предельно разбавленных растворов ( справедливо равенство:
где Электрическая проводимость гипотетического бесконечно разбавленного раствора характеризующегося полной диссоциацией
электролита и отсутствием сил электростатического взаимодействия между ионами. Уравнение (4.8) справедливо как для сильных, так и для слабых электролитов и называется законом независимого движения ионов Кольрауша (законом аддитивности электрической проводимости). Согласно закону Кольрауша, молярная электрическая проводимость при предельном разбавлении равна сумме подвижностей ионов при предельном разбавлении. Численные значения подвижностей ионов время оценены практически для всех ионов и приводятся в справочниках. Например, пользуясь справочными данными, молярную электрическую проводимость предельно разбавленного раствора уксусной кислоты
Сравнение численных значений для различных ионов показывает, что аномально высокими величинами электропроводностей в водном растворе обладают ионы гидроксония В разбавленных растворах слабых электролитов электрическое взаимодействие между ионами мало, поэтому верно:
Из выражения (3.10) следует, что степень диссоциации раствора слабого электролита при изменении концентрации можно определить, используя экспериментальные данные значений молярной электрической проводимости его разбавленных растворов. Так как
Рис.4.2. Зависимость молярной электрической проводимости растворов от их концентрации:
1 - слабый электролит; 2 – сильный электролит. В растворах сильных электролитов изменение молярной электрической проводимости с концентрацией обусловлено влиянием электростатического взаимодействия ионов на скорость их движения. График зависимости молярной электрической проводимости от концентрации раствора для слабых электролитов выражается более крутым уменьшением увеличении концентрации, чем кривая этой же зависимости для сильных электролитов (рис.4.2). Зависимость молярной проводимости раствора от концентрации сильных электролитов изучалась многими исследователями. Наиболее известно эмпирическое уравнение Кольрауша для разбавленных растворов, называемое законом квадратного корня:
Где Эта зависимость подтверждена многочисленными экспериментами и теоретически обоснована в теории Дебая — Гюккеля — Онзагера. В этой теории уменьшение молярной электрической проводимости разбавленных растворов сильных электролитов при увеличении концентрации электролита объясняется уменьшением скорости движения ионов за счет электростатического взаимодействия ионов, окруженных их ионными атмосферами, при движении таких ионов в электрическом поле.
Экспериментальная часть
Кондуктометрия – метод исследования, основанный на измерении электрической проводимости растворов электролитов. Этот метод достаточно прост, точен, позволяет решить ряд важных научно-исследовательских и производственных задач. Измеряя электрическую проводимость растворов, определяют основность органических кислот, растворимость и произведение растворимости малорастворимых соединений, константу и степень диссоциации слабых электролитов,степень минерализации почв, вод и грунтов. Широко используется кондуктометрическое титрование различных (особенно мутных) растворов.
Измерение электрической проводимости растворов электролитов.
Экспериментальное определение электрической проводимости раствора электролита основано на измерении сопротивления раствора при прохождении электрического тока методом компенсации. Для этого используется мостовая схема (рис.4.4):
Рис.4.4. Схема установки для измерения электрического сопротивления раствора:
АВ — реохорд с фиксированными значениями сопротивлений в различных положениях скользящего контакта С; Rм — магазин сопротивлений; Rx — сосуд с исследуемым раствором, сопротивление которого следует определить; Г — нуль-инструмент (гальванометр или осциллограф); Перемещая контакт С по реохорду АВ, добиваются отсутствия тока или его минимума в цепи CD. При этом справедливо соотношение:
Переменный ток высокой частоты в схеме измерения используется для того, чтобы избежать последствий электролиза на электродах в сосуде с исследуемым раствором и для уменьшения емкостного сопротивления. Обязательные условия проведения измерений: 1. Объем раствора во всех измерениях должен быть постоянным. 2. Электроды должны занимать фиксированное положение в сосуде, расстояние между ними не должно изменяться. 3. Материал электродов должен быть химически инертным. 4. Площадь электродов должна быть по возможности большой и не изменяться. Все условия должны поддерживаться постоянными при повторных измерениях.
Определение константы и степени диссоциации слабого электролита Цели работы: 1. Рассчитать константу и степень диссоциации слабого электролита по данным экспериментального определения электрической проводимости его растворов. 2. Исследовать зависимости удельной и молярной электрических проводимостей раствора слабого электролита, а также степени диссоциации слабого электролита от его концентрации в растворе. 3. Убедиться в постоянстве величины константы диссоциации слабого электролита при различных концентрациях. Приборы и реактивы (с использованием магазина сопротивлений): - магазин сопротивлений; - осциллограф; - два электрода в одной обойме для кондуктометрических измерений; - стакан для проведения кондуктометрических измерений; - 0,01 М раствор KCl; - растворы слабых электролитов с концентрацией 0,01 М (уксусная кислота CH3COOH, муравьиная кислота HCOOH, гидроксид аммония NH4OH и др.); - мерный цилиндр на 25,0 см3; - пипетки на 10,0 и 20,0 см3; - лабораторная посуда; - дистиллированная вода. Приборы и реактивы (с использованием учебно- лабораторного комплекса «Химия»): Учебно-лабораторный комплекс «Химия» в комплектации: - центральный контроллер; - модуль «Электрохимия» в комплекте с двумя стаканами вместимостью 50,0 см3, двумя электродами в одной обойме для кондуктометрических измерений; - 0,01 М раствор KCl;
- растворы слабых электролитов с концентрацией 0,01 М (уксусная кислота CH3COOH, муравьиная кислота HCOOH, гидроксид аммония NH4OH и др.); - мерный цилиндр на 25,0 см3; - пипетки на 10,0 и 20,0 см3; - дистиллированная вода. Порядок выполнения работы: 1. Определение постоянной прибора, используемого для измерения сопротивления (электрической проводимости) раствора электролита. 2. Определение сопротивления (электрической проводимости) раствора исследуемого слабого электролита. 3. Расчет удельной и молярной электрических проводимостей растворов слабого электролита. 4. Расчет степени и константы диссоциации слабого электролита. Определение постоянной прибора а) с использованием магазина сопротивлений Постоянной прибора является отношение расстояния между электродами l к площади каждого из электродов S, используемых в электрохимической ячейке для измерения сопротивления раствора R. Согласно уравнению (4.13), для расчета удельной электрической проводимости ( измеряется экспериментально. Для этого измеряют сопротивление (R) раствора электролита, удельная электрическая проводимость которого известна. Обычно для этой цели используют раствор KCl заданной концентрации. Значение удельной электропроводности для этого раствора находят в справочнике. Постоянную прибора находят по уравнению:
Сосуд для измерения промывают дистиллированной водой и исследуемым раствором, приливают 20,0 мл раствора KCL заданной концентрации с помощью мерного цилиндра. Электроды присоединяют к измерительной цепи и, изменяя сопротивление цепи с помощью магазина сопротивлений, добиваются минимального сигнала на осциллографе. Определяемое сопротивление исследуемого раствора
KCl считывают с магазина сопротивлений. Операцию по подбору сопротивлений повторяют 2-3 раза, убеждаясь в правильности полученного результата. Рассчитывают постоянную прибора по уравнению (4.13). б) с использованием учебно-лабораторного комплекса «Химия» Для определения постоянной прибора измеряют электрическую проводимость раствора, удельная электрическая проводимость которого известна. Обычно для этой цели используется 0,01 М раствор KCl. Значение
Сосуд для измерения вместе с электродами промывают дистиллированный водой и исследуемым раствором. Затем в сосуд помещают 20,0 мл 0,01 н. раствора KCl при этом электроды должны быть полностью покрыты раствором. Электроды сосуда подсоединяют к измерительной цепи и определяют его электрическую проводимость, после чего рассчитывают постоянную сосуда по уравнению (4.14).
Определение сопротивления раствора исследуемого электролита при различных концентрациях
а) с использованием магазина сопротивлений В сосуд с электродами, промытый дистиллированной водой, приливают 20,0 мл указанного преподавателем раствора слабого электролита и измеряют его сопротивление (R) по методике, приведенной выше. Результат заносят в таблицу 1. Затем из сосуда пипеткой отбирают 10,0 мл раствора и приливают в него 10,0 мл дистиллированной воды, т.е. разбавляют раствор в два раза. Определяют сопротивление полученного раствора. Операцию последовательного разбавления повторяют еще четыре раза, каждый раз, измеряя сопротивление полученного раствора. Полученные результаты заносят в таблицу 4.1. б) с использованием учебно-лабораторного комплекса «Химия» В сосуд с электродами, отмытый дистиллированной водой, наливают 20,0 мл указанного преподавателем раствора слабого электролита и измеряют его электропроводность по методике приведенной выше и в соответствии с приложением 1. Результат заносят в таблицу. Затем из сосуда отбирают 10,0 мл раствора и приливают 10,0 мл дистиллированной воды, выдержанной при той же температуре что и исследуемый раствор, т.е. разбавляют раствор в 2 раза. Определяют электропроводность полученного раствора. Эту операцию последовательного разбавления повторяют 4 раза, каждый раз, измеряя электропроводность полученного раствора; результаты заносят в таблицу 4.1. Расчет удельной и молярной электрических проводимостей растворов слабого электролита Удельную электрическую проводимость растворов слабого электролита при использовании магазина сопротивлений рассчитывают для каждой (i) концентрации по уравнению (4.15):
Удельную электрическую проводимость раствора слабого электролита при использовании учебно-лабораторного комплекса «Химия» рассчитывают для каждой (i) концентрации по уравнению (4.16):
Результаты расчета для каждой (i) концентрации раствора заносят
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-14; просмотров: 377; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.121.160 (0.301 с.) |
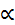 ): отношение числа молекул электролита, распавшихся в растворе на ионы, к первоначальному числу его молекул в растворе. Степень диссоциации электролита в растворе зависит от его природы, концентрации, природы растворителя, температуры и присутствия посторонних электролитов.
): отношение числа молекул электролита, распавшихся в растворе на ионы, к первоначальному числу его молекул в растворе. Степень диссоциации электролита в растворе зависит от его природы, концентрации, природы растворителя, температуры и присутствия посторонних электролитов. 1). К ним относятся вещества, у которых межчастичные связи преимущественно электростатические (соли, сильные кислоты и основания HCl, HNO3, H2SO4, NaOH, KOH, NaCl, K2SO4 и др.).
1). К ним относятся вещества, у которых межчастичные связи преимущественно электростатические (соли, сильные кислоты и основания HCl, HNO3, H2SO4, NaOH, KOH, NaCl, K2SO4 и др.).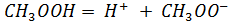
 ; (4.1)
; (4.1) . Эта величина зависит от
. Эта величина зависит от ; (4.2)
; (4.2) - молярная концентрация электролита, моль/л.
- молярная концентрация электролита, моль/л. это способность вещества
это способность вещества :
: ; (4.3)
; (4.3) - удельное сопротивление, Ом м;
- удельное сопротивление, Ом м; 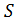 – поперечное сечение
– поперечное сечение ;
;  - длина проводника, м.
- длина проводника, м. электрическая проводимость объема раствора, заключенного
электрическая проводимость объема раствора, заключенного ; (4.4)
; (4.4) . При этом размерность
. При этом размерность 
 раствора электролита
раствора электролита  электрическая проводимость объема раствора электролита, содержащего 1 моль-эквивалент растворенного вещества, находящегося между двумя параллельными электродами, расположенными на расстоянии 1 м друг от друга. Единицей измерения молярной электрической проводимости является
электрическая проводимость объема раствора электролита, содержащего 1 моль-эквивалент растворенного вещества, находящегося между двумя параллельными электродами, расположенными на расстоянии 1 м друг от друга. Единицей измерения молярной электрической проводимости является
 ; (4.5)
; (4.5) - молярная электрическая проводимость, 1/Ом м моль;
- молярная электрическая проводимость, 1/Ом м моль;  ; (4.6)
; (4.6) , поэтому:
, поэтому: ; (4.7)
; (4.7) называются подвижностями ионов, тогда проводимость молярная равна сумме подвижностей:
называются подвижностями ионов, тогда проводимость молярная равна сумме подвижностей: ; (4.8)
; (4.8) ,
,  )
) =
= 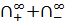 ; (4.9)
; (4.9) - молярная проводимость бесконечно разбавленного электролита,
- молярная проводимость бесконечно разбавленного электролита,  –подвижности ионов при предельном (бесконечном) разбавлении, являются специфическими величинами для ионов.
–подвижности ионов при предельном (бесконечном) разбавлении, являются специфическими величинами для ионов. и
и 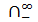 в настоящее
в настоящее можно определить:
можно определить: +
+  = 35+315= 350 1/Ом м моль
= 35+315= 350 1/Ом м моль и гидроксила
и гидроксила  . Это объясняется эстафетным механизмом перемещения указанных ионов в растворе. Поэтому растворы кислот и щелочей по сравнению с растворами солей при одинаковых концентрациях обладают большей электрической проводимостью.
. Это объясняется эстафетным механизмом перемещения указанных ионов в растворе. Поэтому растворы кислот и щелочей по сравнению с растворами солей при одинаковых концентрациях обладают большей электрической проводимостью. ; (3.10)
; (3.10)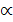 от концентрации раствора.
от концентрации раствора.
 ; (3.11)
; (3.11) — эмпирический коэффициент.
— эмпирический коэффициент. — генератор тока высокой частоты.
— генератор тока высокой частоты. ; (3.12)
; (3.12) ; (4.13)
; (4.13) находят по уравнению:
находят по уравнению: ; (4.14):
; (4.14):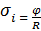 ; (4.15)
; (4.15) ; (4.16)
; (4.16)


