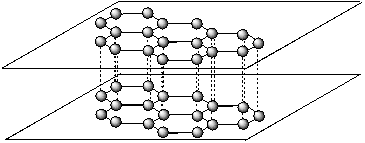Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Элементы 14 группы. Углерод. КремнийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Атомы неметаллов 14 группы периодической системы углерод С и кремний Si имеют электронную конфигурацию ns 2 p 2. Углерод. Содержание углерода в земной коре невелико и составляет ~ 0.32 мас.%. Основная масса углерода встречается в виде карбонатных горных пород – известняков СаСО3 и доломитов СаMg[СО3]2, каменного угля, содержащего 75 – 95 % углерода и природного газа (СН4). Атом углерода по размеру и структуре обладает идеальной электронной оболочкой среди всех элементов периодической системы (рис. 60). Достаточно сравнить электронную конфигурацию атома углерода с электронными структурами соседей по второму периоду и 14 группе, чтобы убедиться в этом. У бора валентных электронов меньше, чем валентных орбиталей. У азота, наоборот, валентных электронов больше, чем орбиталей. Указанные особенности углерода сказались самым благоприятным образом на построении громадного числа разнообразных по структуре и составу органических соединений. В группе соседом углерода является кремний. У него так же, как у углерода, число валентных электронов совпадает с числом валентных орбиталей. Но атомный радиус кремния больше атомного радиуса углерода, и между ядром и валентными электронами располагается не два, а десять экранирующих ядро электронов.
Рис. 60. Электронные модели атомов бора, углерода, азота и кремния в возбужденном состоянии. Пунктирной линией выделены электроны, экранирующие ядро атома по отношению к валентным электронам
Модели атомов можно также изобразить символами химических элементов в окружении валентных электронов (рис. 61).
Рис. 61. Модели, демонстрирующие число валентных электронов и заполнение квантовых ячеек валентными электронами в атомах бора, углерода, азота и кремния в возбужденном состоянии
Указанные модели помогают показать преимущества атома углерода перед соседними атомами в периоде и группе, реализующиеся при образовании четырех прочных ковалентных связей в молекулах органических соединений. Аллотропия углерода Аллотропия (существование химических элементов в виде двух или большего числа структур простых веществ) характерна для ряда элементов, в том числе для углерода. Алмаз С [греч. adamas несокрушимый] – самое твердое кристаллическое природное вещество из всех существующих. Не случайно кристаллы алмаза используют в качестве режущего материала при бурении нефтяных и газовых скважин. В головки буров вставляют алмазы, которые способны при вращении бура разрушить любые горные породы, даже такие, как гранит и базальт. Кристаллическая структура алмаза, образованная атомами углерода, представлена на рис. 62.
Рис. 62. Элементарная ячейка алмаза
Элементарная ячейка образована атомами, расположенными в вершинах куба. Каждый атом углерода находится в центре тетраэдра, вершинами которого служат четыре ближайших атома углерода. Атомы углерода в алмазе образуют четыре ковалентные связи с валентными углами 109о28’. Алмазы, извлеченные из горных пород, часто имеют довольно невзрачный вид, непривлекательный для глаз. И только в случае правильной огранки алмазы превращаются в прозрачные, блестящие ярко сверкающие камни – бриллианты. Принято считать, что кристаллы природного алмаза сгорают на воздухе при температуре 850 оС: С(алмаз) + О2(г) ® СО2(г); △ Н < 0. При нагревании (600 – 700 оС) алмаз переходит в другую аллотропную модификацию – графит. Графит С – мягкий материал серого или черного цвета с металлическим блеском. Как заметил Г. Смит в своей книге «Драгоценные камни» – «…природа превзошла сама себя, создав из одного и того же элемента вещества со столь различными и противоположными свойствами, как твердый, блестящий прозрачный алмаз и мягкий, маркий и непрозрачный графит». Атомы углерода в графите расположены слоями (рис. 63). В каждом слое атомы углерода соединяются прочными s-связями. Но между соседними слоями расстояния слишком велики для образования прочной ковалентной связи. Благодаря такой структуре отдельные слои графита «скользят» и легко отделяются друг от друга, с чем связано использование графита как смазочного материала. Электроны между слоями могут свободно перемещаться, поэтому графит обладает хорошей теплопроводностью и электропроводностью. Фуллерен. В 1996 г. американские ученые Р. Керл, Р. Смоли и Х. Крото получили Нобелевскую премию за открытие особого рода углеродных структур - фуллеренов, которые представляют собой шарообразные молекулы С60. Молекулы фуллеренов полые внутри, а поверхность состоит из 5- и 6-членных углеродных циклов (рис. 64). Известны более сложные фуллерены, состоящие из нескольких сотен атомов углерода. Молекулы фуллеренов образуют молекулярную кристаллическую решетку.
Рис. 63. Структура графита
Рис. 64. Структура молекулы фуллерена С60
В первых опытах фуллерены получали испарением графита в атмосфере гелия под действием электромагнитного излучения мощного лазера. В настоящее время разработаны более простые, но многостадийные способы получения С60 из ClC6H4Br. Фуллерены нашли свое применение в сверхпроводниковой технике, электронике и медицине. Углеродные волокна имеют структуру, сходную со структурой графита. Чтобы получить ткани и другие изделия из углеродных волокон, сначала ткань изготавливают из синтетических и природных материалов, а затем подвергают термической обработке. В результате получают материалы из углеродных волокон, в которых содержание углерода достигает 99.5 %. Такие материалы обладают высокой прочностью, повышенной химической стойкостью. Углеродные материалы и углепластики (материалы, заполненные углеродными волокнами) используются в качестве конструкционных материалов в авиакосмической технике, автомобилестроении, медицине. Аморфный углерод (кокс, древесный уголь, сажа) получают при нагревании без доступа воздуха каменного угля, древесины, углеводородов. Древесный уголь обладает высокой адсорбционной способностью. Такой уголь называют активным (активированным), т.к. он обладает очень большой (развитой) поверхностью, приходящейся на единицу массы. Используется в качестве адсорбента. Сажа широко применяется в качестве наполнителя при изготовлении автомобильных шин.
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 459; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.224.30 (0.007 с.) |