
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Коррозия металлов. Защита от коррозииСодержание книги
Поиск на нашем сайте Разрушение металла, превращение его в оксид, гидроксид или соль в окислительно-восстановительных реакциях с соединениями окружающей среды называется коррозией металла. Когда мы говорим о коррозии металлов, то прежде всего имеем в виду коррозию железа и его сплавов. Железо производится и используется в качестве основного конструкционного материала в количествах, превосходящих все другие металлы. Примерно десятая часть производимого в год металла идет на восполнение потерь, связанных с коррозией. Как только металл выделяется в чистом виде из руды, он немедленно начинает окисляться кислородом воздуха. Исключение составляет золото. Для него реакция окисления кислородом термодинамически запрещена: 4Au(т) + 3O2(г) ® 2Au2O3(т); △ G > 0. Химическая коррозия металла происходит при непосредственном контакте металла с окислителем. Окислителями выступают многие соединения и в первую очередь кислород. Металлы, соприкасающиеся с воздухом, особенно при высокой температуре, подвергаются газовой коррозии. Так происходит окисление железа: 4Fe(т) + 3O2(г)= 2Fe2O3(т). На поверхности железа образуется рыхлая пленка оксида, которая не защищает металл от дальнейшего окисления. На поверхности таких металлов, как Be, Al, Ti, Cr, Ni, Cu, Zn и др., образуется тонкая и прочная пленка оксида, препятствующая дальнейшему окислению металла. Электрохимическая коррозия – это разрушение металла в окислительно-восстановительной реакции в микрогальваническом элементе, возникающем на поверхности металла. Капли воды на поверхности металла способствуют возникновению электрохимической коррозии (рис. 54). Ионы железа Fe2+ переходят с поверхности металлической кристаллической решетки в водный раствор в зоне, которая соответствует аноду: анод (окисление железа): 2Fe ® 2Fe2+ + 4е-. Избыток электронов, возникший в металле, устремляется к участку поверхности металла, выполняющему функцию катода. Происходит восстановление кислорода, растворенного в воде: катод (восстановление): О2 + 2Н2О(ж) + 4е- ® 4ОН-(р-р). В капле раствора идет следующая реакция: 2Fe2+(р-р) + 4НО-(р-р) ® 2Fe(OH)2(т). Гидроксид железа (II) окисляется кислородом, растворенным в воде, и превращается в гидроксид железа (III) буро-красного цвета: 4Fe(OH)2(т)+ O2 + 2H2O(ж) ® 4Fe(OH)3(т). Последний разлагается до оксида железа (III): 2Fe(OH)3(т) ® Fe2O3×H2O (бурый осадок) + 2Н2О(ж). Появление на поверхности металла ржавчины в виде небольших буро-коричневых точек является результатом действия на данном участке микрогальванического элемента. Ржавление происходит на любом доступном каплям воды участке металлической поверхности. Под каплей постепенно уменьшается толщина стенки металла и образуется лунка. Вероятность попадания влаги в образовавшуюся лунку возрастает, и ржавление продолжается до полного разрушения данного небольшого участка металла. Защита железа от коррозии осуществляется:
Рис. 54. Электрохимическая коррозия железа
1) покрытием металла красками, грунтовками по ржавчине. В последнем случае к водной поливинилацетатной дисперсии добавляют небольшое количество NaH2PO4. Образующееся при взаимодействии NaH2PO4 с ржавчиной фосфорнокислое железо Fe(H2PO4)3 не растворяется в воде и выполняет функцию защитного покрытия, предотвращающего дальнейшее ржавление металла. 2) покрытием железа цинком (цинкованная листовая сталь используется в автомобилестроении, а также как кровельный материал), оловом (белая жесть - листовая сталь, покрытая слоем олова, широко используется при изготовлении консервных банок), хромом. Указанные покрытия образуют при взаимодействии с кислородом воздуха прочную тонкую оксидную пленку, которая защищает железо от коррозии. 3) легированием, например получением сплава железа, содержащего 18 мас.% никеля и 8 мас.% хрома (нержавеющая сталь). Предотвращение ржавления стали происходит по тому же принципу, что и при покрытии железа хромом. 4) катодная или электрохимическая защита широко используется для предотвращения коррозии стальных трубопроводов, по которым перекачивается нефть и природный газ (рис. 55).
Рис. 55. Электрохимическая (катодная) защита стального трубопровода
При катодной защите стальной трубопровод подсоединяется к катоду источника постоянного тока и на металле возникает отрицательный заряд. Он затрудняет переход положительно заряженных ионов железа в раствор.
5.7. Металлы f -элементов Металлы f -элементов включают: лантаноиды и актиноиды – элементы 6 и 7 периодов, в атомах которых заполняются соответственно 4 f - и 5 f -орбитали. Среди металлов f -элементов рассмотрим уран U и плутоний Pu, точнее радионуклид Уран изменил жизнь человечества в середине ХХ в. Группой физиков во главе с Э. Ферми был запущен первый атомный реактор в Чикаго в 1942 г. в период Второй мировой войны. А в 1945 г. американцами были сброшены атомные бомбы на японские города Хиросима и Нагасаки. Перед человечеством возникла реальная угроза погибнуть в ядерной катастрофе в случае применения ядерного и термоядерного оружия в военном конфликте. Важнейшими рудами урана являются настуран U3O8, и уранинит (U,Th)O2. В рассеянном виде в толще земной коры содержатся, главным образом радиоактивные соединения урана U, тория Th и калия К.
Отступление. Ядра атомов химических элементов, содержащие 84 и более протонов, неустойчивы и самопроизвольно распадаются. Все элементы периодической системы, начиная с полония Ро (заряд ядра 84) и завершающим 7 период элементом с зарядом ядра 118, состоят исключительно из радиоактивных нуклидов (nuclear- ядро). Радиоактивный распад (радиоактивность) – самопроизвольное превращение нестабильных атомных ядер в ядра других элементов, сопровождающийся излучением a-, b-частиц, рентгеновского или g-излучения. Распад радиоактивных химических элементов не зависит от состава химических соединений, в которых они находятся. Лишь состав ядер, скорость и вид радиоактивного распада отличают радионуклиды. a -Распад сопровождается выбросом из радиоактивного ядра a-частицы (ядра атома гелия). Рассмотрим силы, которые обеспечивают устойчивость атомного ядра. Кулоновское отталкивание, существующее между протонами в ядре, стремится его разрушить. Однако существует обменное или сильное взаимодействие, которое удерживает вместе нуклоны (нуклоны - частицы атомного ядра – протоны и нейтроны), и противодействует кулоновскому отталкиванию. Обменное взаимодействие между нуклонами действует на расстоянии 10-15 м, соответствующему размеру атомного ядра. Чтобы понять, как обменное взаимодействие может удерживать вместе нуклоны, воспользуемся следующей моделью. Представим, что два человека должны удерживать большой круглый и тяжелый камень (В.И. Григорьев и Г.Я. Мякишев «Силы в природе»). По условию камень нельзя бросать на пол и невозможно нести вдвоем. Приходится его передавать друг другу поочередно. Для этого несущие камень должны всегда быть вместе, не отрываясь друг от друга. Нечто подобное происходит в атомном ядре. Протоны и нейтроны обмениваются энергией (p-мезонами). Обмен нуклонов энергией обеспечивает важное качество – устойчивость ядра. Однако устойчивость ядра резко падает, когда количество нейтронов и протонов превышает 200 частиц. Часть протонов и нейтронов может выйти за пределы размеров ядра (10-15 м). Тогда неизменно присутствовавшее кулоновское отталкивание становится определяющим фактором. Так происходит, например радиоактивный (a-распад) урана-238 (рис. 56), сопровождающийся испусканием ядер атомов гелия:
Рис. 56. Радиоактивный распад с испусканием из материнского ядра a-частицы (ядра атома гелия)
b --Распад. В отличие от протона
В составе стабильных атомных ядер нейтроны устойчивы благодаря обменному взаимодействию. В радионуклиде существует вероятность распада нейтрона на протон с испусканием из ядра электрона. Так происходит b--распад. Например, образующиеся в атомном реакторе радионуклиды йода-131 распадаются:
Возможны и другие виды радиоактивного распада (позитронный и К-захват), которые здесь не обсуждаются. Любой из видов радиоактивного распада ядер сопровождается выделением энергии, носителем которой являются не только движущиеся с высокой скоростью a- и b-частицы, но и поток электромагнитного g-излучения. Радиоактивное излучение представляют опасность для живых систем, особенно если его энергия превышает естественную радиоактивность природной среды.
Ядерные реакции Ядерные реакции осуществляются при бомбардировке атомного ядра нейтронами, протонами, электронами или ядрами других элементов, сопровождающиеся изменением состава ядер. Если радиоактивный распад осуществляется самопроизвольно, то ядерные реакции происходят при воздействии на ядро извне. Реакция деления атомных ядер используется для получения энергии на атомных электростанциях и в различных видах ядерного оружия.
Рис. 57. Цепная реакция деления урана-235. Деление одного ядра под действием нейтрона сопровождается выделением нескольких нейтронов, которые в свою очередь вызывают деление новых ядер урана-235 Уран-235 делится различными способами, например, возможно такое деление:
Делящегося металла должно быть такое количество и его атомы должны быть на таком расстоянии, чтобы нейтроны имели возможность, сталкиваясь с ядрами, продолжить цепное деление.
Атомная бомба В атомной бомбе атомный взрыв достигается двумя способами (рис 58).
Рис. 58. Схема устройства атомной бомбы (по Э. Дж Холлу «Радиация и жизнь»)
В одном случае заряд бомбы состоит из двух субкритических масс радиоактивного вещества, урана-235 или плутония-239. Когда массы уранового заряда соединяются практически мгновенно вместе, образуется критическая масса металла. В таком количестве массы происходит неконтролируемая цепная ядерная реакция деления – атомный взрыв (рис. 58, а). В случае атомного заряда, представленного на рис. 58, б, критическая масса достигается при сжатии урана или плутония. Размер атомных бомб, сброшенных на японские города, невелик. Одна из них («Малыш») была длиной 3,1 м и диаметром 70 см, содержала урановый заряд. Другая («Толстяк») имела длину 3.2 м и диаметр 1.5 м и содержала плутониевый заряд. Атомными бомбами было уничтожено население и здания двух городов (Хиросима и Нагасаки). Оставшиеся в живых люди подверглись радиоактивному облучению.
Атомная электростанция Атомная электростанция работает в условиях контролируемой и управляемой цепной реакции деления урана-235, идущей в ядерном реакторе. В отличие от атомной бомбы, в которой делящимся веществом является металлический уран-235 или плутоний-239, в ядерном реакторе используется оксид урана UO2, содержащий изотопы: уран-238 (~ 97%) и уран-235 (~ 3%). Делящимся веществом является уран-235. Каждый акт деления сопровождается выделением энергии. Температура повышается в результате увеличения скорости разлетающихся продуктов (осколков деления). Масса образовавшихся продуктов деления лишь немного меньше массы исходного делящегося урана-235. Уменьшение массы сопровождается выделением эквивалентного исчезнувшей массе количества энергии в форме теплоты и электромагнитного излучения. В соответствии с законом сохранения массы-энергии: Е = mc 2, можно оценить количество энергии, которое выделяется в ядерной реакции деления. Уменьшение массы вещества на 1 г эквивалентно выделению энергии в количестве: Е = mc 2 = 1×10-3 кг (3×108)2 м2с-2 = 9×1013 Дж. Для сравнения такое же количество энергии в форме теплоты выделится при сжигании 3000 т каменного угля, содержащего 93 мас.% углерода: С(т) + О2(г) ® СО2; △ Н = -393.5 кДж/моль.
Отступление. Чтобы иметь представление о современной атомной электростанции, рассмотрим некоторые особенности ее устройства (рис. 59).
Рис. 59. Схема реактора атомной электростанции
Стальной реактор высотой 21 м и шириной 9 м с толщиной стенок 20 см закрыт бетонной защитной оболочкой, исключающей выход потока нейтронов и g-излучения в окружающую среду. Внутри реактора располагаются тепловыделяющие элементы и стержни управления и защиты. Реактор заполнен водой – замедлителем быстрых нейтронов (медленные нейтроны вызывают деление урана-235). Вода выполняет также функцию теплоносителя. Тепловыделяющие элементы (твэлы) длиной 3.7 м представляют собой герметично закрытые трубки диаметром 10 мм из сплава циркония, заполненные таблетками (размером с наперсток) оксида урана UO2. Всего в реактор помещают массу ядерного топлива, содержащуюся в 40 000 – 50 000 стержней. В такой массе осуществляется самоподдерживающаяся цепная реакция деления. Контрольные стержни из самария Sm, европия Eu или гадолиния Gd (f -элементы) предназначены для поддержания стационарной работы ядерного реактора. Они захватывают медленные нейтроны и не позволяют развиваться неконтролируемому цепному делению урана-235 и перегреву ядерного реактора. В случае аварийной ситуации или при остановке реактора для замены отработанных твэлов контрольные стержни погружают в пространство между твэлами для полного поглощения нейтронов. При эксплуатации атомных электростанций существуют проблемы, связанные с авариями. Такие аварии произошли в США (1979 г.) и в СССР (крупнейшая авария на Чернобыльской АЭС, 1986 г.). Существуют серьезные проблемы с переработкой и хранением радиоактивных отходов, большинство из которых (после выделения из отходов урана и плутония) имеют период полураспада не превышающий 30 лет. Период полураспада t 1/2 – время, необходимое для превращения половины любого заданного количества вещества. Скорость распада радиоактивного вещества подчиняется уравнению реакции первого порядка. Например, радиоактивный распад каждого ядра тория-232 сопровождается испусканием a-частицы: Th-232 ® Ra-228 + a-частица Специальное устройство (счетчик Гейгера) позволяет регистрировать a-частицы и измерять скорость радиоактивного распада:
При интегрировании получаем: где N 0 – исходное число ядер тория-232 в момент времени t = 0; N – число ядер, не распавшихся по истечении времени t; k – константа радиоактивного распада Так как t = t 1/2, если N = N 0/2, то между константой скорости радиоактивного распада и периодом полураспада существует следующее соотношение:
Период полураспада тория-232 можно определить, не дожидаясь, когда распадется половина ядер радионуклида. Например, если счетчик Гейгера регистрирует 57 a-частиц, испускаемых в минуту образцом, содержащим 10-6 моль соединения тория-232, то u = kN 0 57 = k 10-6×6.02×1023, где 6.02×1023 – число Авогадро k = 9.468 10-17 мин-1 t 1/2 = 0.693/9.468 10-17 мин или 1.4×1010 лет. Практика эксплуатации ядерных реакторов показала, что атомная электростанция мощностью 1000 МВт потребляет в год 175 т урана. Такой же мощности тепловая электростанция сжигает 2 млн т угля.
Краткий итог темы 1. В земной коре встречаются все химические элементы (за исключением искусственно синтезированных), но основными являются 8 элементов. На долю O, Si, Al, Fe, Ca, K, Na, Mg приходится почти 99 мас.% земной коры. 2. Структура кристалла металла рассматривается как гигантская молекула с подвижным электронным облаком, удерживающим положительно заряженные ионы металла в узлах кристаллической решетки (металлическая связь). 3. Металлы проявляют высокую электропроводность и теплопроводность, обусловленную подвижными электронами. 4. Среди химических свойств металлов основным является способность отдавать валентные электроны в окислительно-восстановительных реакциях и переходить в ионное состояние в оксидах, основаниях и солях. 5. Железо среди металлов является основным конструкционным материалом. 6. Алюминий, медь – основные электропроводящие материалы, а металлы платиновой группы самые коррозионностойкие материалы. 7. Атомная энергетика основана на двух металлах из группы f -элементов: уране U и плутонии Pu. Уран и плутоний служат источником энергии, выделяющейся в результате деления ядер элементов в реакторах атомных электростанций или в атомных бомбах. Термины для запоминания Коррозия металла - разрушение металла, превращение его в оксид, гидроксид или соль в окислительно-восстановительных реакциях с соединениями окружающей среды. Легирование – придание металлу коррозионной стойкости, высокой упругости и прочности путем введения в состав железа небольших количеств таких элементов, как V, W, Cr, Mo, Si, Ti. Металлическая связь –вид химической связи, обусловленный взаимодействием валентных электронов с положительно заряженными ионами металла. Пассивность металла – повышенная коррозионная стойкость в условиях, когда реакция термодинамически разрешена, но не идет. Экспериментально установленная пассивность металла используется при перевозке концентрированных серной и азотной кислот в стальных железнодорожных цистернах. Период полураспада t1/2 – время, необходимое для превращения половины любого заданного количества вещества. Радиоактивный распад (радиоактивность) – самопроизвольное превращение нестабильных атомных ядер в ядра других элементов, сопровождающееся a-, b- g-излучением. Химическая коррозия – окисление металла при непосредственном контакте его с окислителем. Электрохимическая коррозия - процесс окисления металла в микрогальваническом элементе, возникающем на участке поверхности металла, покрытого водой. Ядерная реакция – изменение состава ядра при бомбардировке его нейтронами, протонами, электронами или ядрами других элементов.
Вопросы для проверки знаний 1. Что подразумевается под понятиями электропроводность, теплопроводность, пластичность вещества? 2. Почему металлы проявляют высокую пластичность, электропроводность и теплопроводность? 3. Какие реакции называются окислительно-восстановительными? Почему металлы выступают в качестве восстановителей в окислительно-восстановительных реакциях? 4. Алюминий энергично окисляется, а золото не окисляется кислородом. Объясните, почему и тот и другой металл успешно используются в качестве проводников электрического тока? 5. Почему не железо, а медь, золото, серебро, олово и свинец были первыми металлами, которые в древности использовал человек в практической деятельности? 6. Назовите причины, по которым промышленное получение таких металлов, как щелочные металлы и алюминий, осуществляется электрохимическим методом 7. Какой металл известен своим антибактериальным действием? 8. Где в ряду активности металлов находится железо и как это определяет его отношение к кислотам? 9. Почему железо подвергается коррозии на воздухе, а химически более активные металлы алюминий и магний устойчивы к коррозии? 10. Какие металлы являются источником энергии в тепловыделяющих элементах атомных электростанций?
Упражнения 1. Нарисуйте модель кристаллической решетки металла. Покажите характер изменения состояния кристаллической решетки металла: а) при электропроводности; б) теплопроводности. 2. Нарисуйте схему электролизера и напишите электродные реакции, протекающие на катоде и аноде при получении металлического натрия. 3. Напишите реакцию восстановления железа из оксида железа в доменной печи. 4. Выскажите предположение, почему зола, образующаяся при сжигании каменного угля на электростанциях, имеет повышенную радиоактивность по сравнению с естественным радиоактивным фоном окружающей среды. 5. Вычислите время, необходимое для радиоактивного превращения металлического полония-210 на 99%, если известно, что период полураспада
ТЕМА 6 НЕМЕТАЛЛЫ Неметаллы представлены 22 элементами периодической системы. За исключением водорода (s -элемента) остальные неметаллы – р -элементы. Кислород и кремний составляют почти 78 мас.% земной коры. В этом легко убедиться, если рассчитать долю кислорода и кремния в наиболее распространенных минералах горных пород (силикатах и алюмосиликатах), например, таких, как каолинит Al2[Si2O5](OH)4, ортоклаз К[AlSi3O8], анортит Ca[Al2Si2O8], кварцевый песок SiO2. Отметим два признака, которые отличают неметаллы от металлов. В пределах одного периода: 1) радиусы атомов неметаллов меньше радиусов атомов металлов; 2) энергия ионизации атомов неметаллов больше энергии ионизации атомов металлов, поэтому в окислительно-восстановительных реакциях с металлами неметаллы выступают как окислители. Положение металлов и неметаллов в периодической системе элементов является следствием заполнения электронных оболочек атомов в соответствии с квантовыми правилами. Периодичность изменения электронной конфигурации атомов приводит к повторению физических и химических свойств элементов через правильные интервалы. Каждый новый период открывается щелочным металлом и завершается благородным газом (неметаллом). Переход от одного периода к следующему происходит скачком. В этом легко убедиться, сравнивая изменение атомных радиусов и энергии ионизации от заряда ядра атома (рис. 51 и 52).
6.1. Элементы 18 группы. Благородные газы Благородные газы (гелий He, неон Ne, аргон Ar, криптон Kr, ксенон Xe и радон Rn) входят в 18 группу периодической системы, они завершают периоды. Атомы элементов имеют электронную конфигурацию с полностью заполненной np 6-орбиталью (у гелия 1 s 2-орбиталь). Такая конфигурация электронных оболочек определяет химическую инертность одноатомных благородных газов. В природе благородные газы находятся в атмосфере, гидросфере и литосфере. Самым распространенным среди них является аргон, его содержание в атмосфере составляет ~1 % по объему, точнее 0.934 об.%. Гелий He выделяют из гелионосных горючих газов. Радон получают как побочный продукт при переработке ураносодержащих руд. Неон, аргон, ксенон и криптон получают из воздуха как побочные продукты разделения воздуха на азот и кислород. Гелий применяется в качестве носителя в хроматографии. Смесь кислорода и гелия используется вместо воздуха водолазами. Аргон используется для создания инертной атмосферы при сварочных работах. Неон и криптон используют в газоразрядных трубках (реклама). Радон – радиоактивный газ (a-излучатель). Период полураспада самого долгоживущего радионуклида Rn-222 3.8 сут.
|
|||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 334; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.41.108 (0.009 с.) |



 Pu, получаемый в ядерных реакторах при длительном облучении нейтронами урана-238.
Pu, получаемый в ядерных реакторах при длительном облучении нейтронами урана-238.

 (или р+) – стабильной частицы, среднее время жизни свободного нейтрона
(или р+) – стабильной частицы, среднее время жизни свободного нейтрона 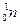 (верхний индекс соответствует массовому числу, нижний – заряду частицы) составляет всего 15.3 мин. Затем он распадается на протон р + и электрон е- (масса электрона почти в 2000 раз меньше массы протона, поэтому верхний индекс у электрона условно принимаем равным нулю):
(верхний индекс соответствует массовому числу, нижний – заряду частицы) составляет всего 15.3 мин. Затем он распадается на протон р + и электрон е- (масса электрона почти в 2000 раз меньше массы протона, поэтому верхний индекс у электрона условно принимаем равным нулю): ®
®  .
. .
. Практическое значение имеют три радионуклида
Практическое значение имеют три радионуклида  и
и  . Последний иногда называют оружейным плутонием. Схема ядерного деления, сопровождающаяся выделение энергии в форме теплоты и электромагнитного излучения, представлена на рис. 57.
. Последний иногда называют оружейным плутонием. Схема ядерного деления, сопровождающаяся выделение энергии в форме теплоты и электромагнитного излучения, представлена на рис. 57.
 ®
®  +
+  + 2
+ 2 
 или 3000 т.
или 3000 т.
 или
или  .
. .
. ,
, или t 1/2 = 0.693/ k.
или t 1/2 = 0.693/ k. Ро равен 138 дней. Какое вещество образуется при радиоактивном распаде
Ро равен 138 дней. Какое вещество образуется при радиоактивном распаде 


