
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Осмотическое давление. Закон вант-гоффаСодержание книги
Поиск на нашем сайте
Осмос (др.-греч. wsmoV толчок, давление) есть явление самопроизвольного перехода молекул растворителя из более разбавленного в менее разбавленный раствор. Это явление наблюдается в том случае, когда оба раствора отделены друг от друга полупроницаемой перегородкой, пропускающей только растворитель (рис. 32).
Рис. 32. Схема прибора, демонстрирующего явление осмоса
В левом сосуде (рис. 32) полупроницаемой перегородкой разделены раствор соли в воде и чистая вода. В термодинамически неравновесной системе происходит самопроизвольный процесс выравнивания концентраций путем проникновения молекул воды через полупроницаемую перегородку в концентрированный раствор соли. Преградой такому движению растворителя служит увеличивающееся давление столба жидкости, как показано в правом сосуде на рис. 32. Процесс выравнивания концентраций останавливается при достижении некоторого давления p. Перепад уровней между раствором и чистым растворителем в правом колене отражает осмотическое давление воды p. К осмотическому давлению применимы законы газового состояния: p V = nRT илиp = сRT, где V – объем раствора, n – количество моль растворенного вещества, R – газовая постоянная, Т – абсолютная температура. Последнее уравнение называется законом Вант-Гоффа. Явление осмоса играет важную роль в жизни растений и живых организмов. У млекопитающих осмотическое давление большинства биологических жидкостей равно осмотическому давлению крови. Осмотическое давление, создаваемое в клетках животных растворами белков, полисахаридов и др., незначительно, но играет важную роль в обмене веществ. Свойства, зависящие от количества составляющих раствора, а не от природы его частиц, называют коллигативными свойствами растворов. Законы Рауля р1 = р10N1; Генри с = к г. р; Вант-Гоффа p = сRT; а также повышение температуры кипения и понижение температуры замерзания водного раствора нелетучего вещества DТ кип. = Э×сm, и DТ кр. = Ксm отражают проявление растворами коллигативных свойств.
Краткий итог темы 1. Растворы это однородные (гомогенные) системы, состоящие из двух или большего числа компонентов, имеющих молекулярную, ионную или атомную степень раздробленности. 2. В гомогенных системах (растворах) существуют наиболее благоприятные условия для контакта реагентов (атомов, молекул или ионов) во всем объеме. Если необходимо увеличить скорость процесса, то гомогенные реакции предпочтительнее гетерогенных, так как в гетерогенных системах участие реагентов в реакции ограничено поверхностью раздела фаз. 3. Концентрацию вещества в растворе выражают различными способами. Отношение количества n моль растворенного вещества, содержащегося в V л раствора, с = n / V моль/л выражает молярность раствора. Отношение количества ni моль вещества данного компонентак суммарному количеству (S ni) моль всех веществ, составляющих раствор, N = ni / Snj выражает молярную долю соединения в растворе. Отношение массы mi кг данного растворенного вещества к массе (S mj) кг раствора выражает массовую долю растворенного вещества. Массовая доля может быть выражена в долях единицы или в процентах: w = mi / Smj или w = 100 mi / Smj, %. 4. Свойства разбавленных растворов по своим характеристикам приближаются к свойствам идеальных растворов, в которых отсутствует взаимодействие между частицами. Свойства, зависящие от количества, но не от природы частиц раствора, называют коллигативными свойствами растворов. Законы Рауля р 1 = р 1 0N 1; Генри с = к г ×р; Вант-Гоффа p = сRT; эбулиоскопия DТ кип = Э×сm, и криоскопия D Т кр = Ксm отражают проявление растворами коллигативных свойств.
Термины для запоминания Насыщенный раствор - гомогенная смесь, содержащая наибольшее при данной температуре количество растворенного вещества. Осмос – явление самопроизвольного перехода молекул растворителя из более разбавленного раствора в менее разбавленный, если оба раствора отделены друг от друга полупроницаемой перегородкой. Осмотическим давлением (p) называют избыточное гидростатическое давление, возникающее в результате осмоса. Растворами называют однородные (гомогенные) системы, состоящие из двух или большего числа компонентов, имеющих молекулярную, ионную или атомную степень раздробленности. Растворимость (S) определяется количеством вещества, которое способно раствориться в данном количестве растворителя с образованием насыщенного раствора при постоянной температуре и давлении. Вопросы для проверки знаний 1. Какой раствор называют идеальным и чем реальный раствор отличается от идеального? 2. Какое различие существует между растворами и дисперсными системами? 3. Можно ли теоретически предсказать растворимость вещества? 4. Какие способы выражения концентрации вещества в растворе являются безразмерными? 5. Возрастает ли с увеличением температуры растворимость: а) газов; б) жидкостей; в) твердых веществ в воде? 6. Связано ли кипение воды и образование пузырьков пара с местным перегревом жидкости? 7. Увеличивается ли температура кипения водного раствора нелетучего вещества по сравнению с чистой водой? 8. Увеличивается ли температура замерзания водного раствора нелетучего вещества по сравнению с чистой водой? 9. Какой физико-химический процесс лежит в основе осмотических явлений?
Упражнения 1. Экспериментально установлено, что в водах Мирового океана растворено углекислого газа в 60 раз больше, чем его содержится в атмосфере. Напишите химические превращения СО2 при растворении в морской воде. 2. В растворе содержится нелетучий компонент. Докажите, что уравнение 3. В закрытом сосуде находятся два стакана. Один содержит чистую воду, другой – раствор нелетучего компонента. Изменятся ли со временем уровни жидкости в стаканах? 4. Объясните, почему температуры замерзания растворов сахара (0.2 моль/л) и соли (0.2 моль/л) будут различаться. 5. В коленах U-образного сосуда, разделенных мембраной, содержится раствор соли (левое колено) и чистая вода (правое колено). Предложите способ получения чистой воды из солевого раствора, используя свойства мембраны. 6. Какая масса хлорида натрия (поваренная соль) и воды необходима для приготовления 400 г раствора с массовой долей соли 2%?
ТЕМА 4 РАСТВОРЫ ЭЛЕКТРОЛИТОВ Обнаружение растворов, которые проводят электрический ток, послужило началом исследований электролитов. Электролиты – вещества, расплавы и растворы которых обладают ионной проводимостью электрического тока. Характерными структурными единицами электролитов являются ионы (рис. 33).
Рис. 33. Электролит NaCl: а) в твердом состоянии (кристалл соли); б) в жидком состоянии (в расплаве при Т >8010C)
Появление теории электролитической диссоциации, разработанной шведским физико-химиком С. Аррениусом (1859-1927), послужило мощным толчком быстрого развития электрохимии. Изучая свойства растворов различных соединений, Аррениус обратил внимание на свойства некоторых растворов проводить электрический ток. На основании своих наблюдений он сформулировал положение о том, что при растворении некоторых веществ в воде они самопроизвольно распадаются на заряженные частицы - ионы. Такие растворы обладают ионной проводимостью.
|
|||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 343; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.108.8 (0.005 с.) |


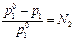 , где N 2 – мольная доля нелетучего компонента, есть аналитическое выражение закона Рауля.
, где N 2 – мольная доля нелетучего компонента, есть аналитическое выражение закона Рауля.



