
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Значения рН некоторых жидкостейСодержание книги
Поиск на нашем сайте
Сильные электролиты полностью диссоциируют на ионы в воде. Слабые электролиты лишь частично распадаются на ионы, и мерой этого свойства являются два параметра: степень диссоциации a и константа диссоциации слабого электролита Кс. Последний параметр используется для оценки способности слабых электролитов диссоциировать. Рассмотрим связь между константой диссоциации К с и степенью диссоциации a такого слабого электролита, как бензойная кислота. С6Н5СООН(р-р) ⇄ С6Н5СОО-(р-р) + Н+(р-р). Константа диссоциации Кс определяется отношением произведения равновесных концентраций катионов и анионов к равновесной концентрации недиссоциированных молекул слабого электролита:
Начальная концентрация растворенной в воде бензойной кислоты с 0. Равновесные концентрации ионов бензойной кислоты и водорода одинаковы и равны a× с0. Равновесная концентрация недиссоциированной бензойной кислоты равна:
Подставим значения равновесных концентраций в выражение константы диссоциации К с:
Для слабых кислот степень диссоциации существенно меньше единицы. При a << 1 величина (1-a) @ 1, и выражение константы диссоциации слабой кислоты имеет следующий вид: К с = a2 с 0. Константа диссоциации зависит только от температуры. Отметим важное свойство слабых электролитов: чем больше начальная концентрация электролита с 0, тем меньше степень его диссоциации, что следует из нижеприведенного соотношения:
Пример. Определить степень диссоциации 0,1М водных растворов уксусной и бензойной кислот. Константы диссоциации кислот соответственно равны 1,8.10-5 и 6,3.10-5 при 25 оС. Решение Для вычисления a воспользуемся уравнением a = (Кд /С0)1/2. Для 0,1М уксусной кислоты в воде: a = (1,8 10-5 / 10-1)1/2 = (0,00018)1/2 = 0,0134. Для 0,1М бензойной кислоты в воде: a = (6,3 10-5 / 10-1)1/2 = (0,00063)1/2 = 0,025. Следовательно, при 25 оС уксусная кислота диссоциирует на 1,34%, а бензойная кислота на 2,5%.
Реакции электролитов Основность кислоты определяется числом ионов водорода, которые образуются при её диссоциации.
1)Реакции диссоциации слабых кислот Диссоциация одноосновной циановодородной кислоты: HCN ⇄ H+ + CN Kc = Диссоциация двухосновной угольной кислоты: Н2СО3 ⇄ H+ + НСО3- К 1 НСО3- ⇄ H+ + СО32- К 2(К 1 >К 2) Диссоциация трехосновной ортофосфорной кислоты: Н3РО4 ⇄ H+ + Н2РО4- К 1 Н2РО4-⇄ H+ + НРО42- К 2 НРО42-⇄ H+ + РО43- К 3(К 1 >К 2 >К 3) 2) Необратимые реакции нейтрализации сильной кислоты сильной щелочью сопровождаются образованием соли и воды. Раствор становится нейтральным (рН = 7): НСl(р-р) + КОН(р-р) ® КСl(р-р) + Н2О(ж) Полное ионное уравнение выглядит следующим образом: Н+(р-р) + Сl-(р-р) + К+(р-р)+ОН-(р-р)®К+(р-р)+Сl-(р-р)+Н2О(ж) Ионное уравнение в сокращенном виде: Н+(р-р) + ОН-(р-р) ® Н2О(ж) Реакции гидролиза Соли – сильные электролиты. При растворении в воде они образуют гидратированные катионы и анионы. Если катионы или анионы соли при взаимодействии с водой образуют слабый электролит, то среда раствора становится либо щелочной, либо кислой. Гидролизом называют реакцию ионов солей с водой, изменяющую рН среды с электронейтральной на кислую или щелочную. Приведем примеры реакций гидролиза солей. а) Гидролиз соли,образованной слабой кислотой и сильным основанием: СН3СООNa(р-р) + Н2О(ж) ⇄ СН3СООН(р-р) +NaOH(р-р) Полное ионное уравнение: СН3СОО-(р-р)+Na+(р)+Н2О(ж)⇄СН3СООН(р-р)+Na+(р-р)+ОН- Ионное уравнение в сокращенном виде: СН3СОО-(р-р)+Н2О(ж)⇄ СН3СООН(р-р)+ +ОН- Соли, образованные слабыми кислотами и сильными основаниями, гидролизуются с образованием ионов гидроксида ОН-, среда становится щелочной (рН > 7). б) Гидролиз соли,образованной сильной кислотой и слабым основанием: NH4Cl(р-р) + H2O(ж) ⇄ HCl(р-р) + NH4OH(р-р) Полное ионное уравнение: NH4+(р-р)+Cl-(р-р)+H2O(ж) ⇄ H+(р-р) + Cl-(р-р) + NH4OH(р-р) Ионное уравнение в сокращенном виде: NH4+(р-р) + H2O(ж) ⇄ H+(р-р) + NH4OH(р-р) Соли, образованные сильными кислотами и слабыми основаниями, гидролизуются с образованием ионов водорода Н+, среда становится кислой (pH < 7). Аналогично проходит реакция гидролиза AlCl3: AlCl3(р-р) + H2O(ж) ⇄ Al(OH)Cl2(р-р)+ H+(р-р)+ Cl-(р-р) Полное ионное уравнение: Al3+(р-р)+3Cl-(р-р)+ H2O(ж) ⇄Al(OH)Cl2(р-р)+ H+(р-р)+ Cl-(р-р) Ионное уравнение в сокращенном виде: Al3+(р-р)+2Cl-(р-р) + H2O(ж) ⇄Al(OH)Cl2(р-р)+ H+(р-р)
Среда в растворе кислая. Заметим, что соли, образованные сильными кислотами и сильными основаниями, например такие, как NaCl, не гидролизуются и не изменяют рН раствора (рН = 7). Легко происходит гидролиз солей, образованных слабыми кислотами и слабыми основаниями. В зависимости от относительной силы кислоты или основания будет меняться кислотность водного раствора. 4) Реакции осаждения (образование нерастворимой соли) СаСl2(р-р) + Na2SO4(р-р) ® 2NaCl(р-р) + CaSO4(т)¯ Полное ионное уравнение: Ca2+(р-р)+2Сl-(р)+2Na+(р-р)+SO4(р-р)®2Na+(р-р)+2Cl-(р-р)+CaSO4(т)¯ Ионное уравнение в сокращенном виде: Ca2+(р-р)+ SO4(р-р)® CaSO4(т)¯ 5) Реакции образования газообразного вещества СaCO3(т) + 2HCl(р-р) ® CaCl2(р-р) + Н2О(ж) + CO2(г) Полное ионное уравнение: СaCO3(т)+2H+(р-р)+2Cl-(р-р)®Ca2+(р-р) +2Cl-(р-р) +Н2О(ж)+CO2(г) Ионное уравнение в сокращенном виде: СaCO3(т) + 2H+(р-р) ® Ca2+(р-р) + Н2О(ж)+ CO2(г) Ионные реакции, идущие с образованием нерастворимых в воде веществ, улетучивающихся из раствора газов, или малодиссоциирующих соединений, являются необратимыми. Если малодиссоциирующие соединения есть в левой и правой частях уравнения, то реакция обратимая.
|
||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 243; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.32.78 (0.009 с.) |

 .
.
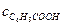 = (с 0-a× с 0) = с 0(1-a).
= (с 0-a× с 0) = с 0(1-a).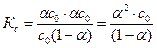 .
.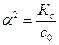 или a = (Кд /С0)1/2.
или a = (Кд /С0)1/2.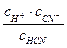 .
.


