Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физические свойства растворов. Закон РауляСодержание книги
Поиск на нашем сайте
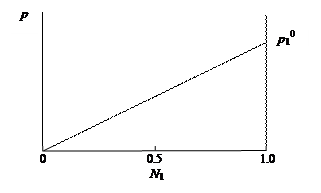
Исследования растворов, выполненные французским физиком и химиком Ф. Раулем, позволили установить следующий закон, носящий его имя: давление пара раствора, содержащего нелетучее растворенное вещество, прямо пропорционально мольной доле растворителя. р 1 = р 1 0 N 1, где р 1 и р 1 0 – давление пара растворителя над раствором ичистым растворителем; N 1 – мольная доля растворителя в растворе. Линейная зависимость давления пара растворителя над раствором в координатах р – N 1 представлена на рис. 29.
Рис. 29. Зависимость парциального давления пара р 1 растворителя от мольной доли N 1 растворителя в растворе
Закон Рауля выполняется лишь для идеальных растворов. Идеальный раствор состоит из компонентов, энергия взаимодействия между которыми одинаковая и не зависит от природы входящих в состав раствора веществ. Следствием идеальности раствора является характер зависимости между парциальным давлением пара компонента и его концентрацией в растворе. Изменение концентрации компонента в растворе приведет к пропорциональному изменению его парциального давления над раствором, т.е. давление пара растворителя (р 1) над раствором, содержащим нелетучее вещество, линейно изменяется с ростом мольной доли растворителя (рис. 29).
В реальных растворах наблюдаются значительные отклонения от закона Рауля. Например, такие отклонения можно наблюдать для водного раствора тростникового сахара (рис. 30).
Рис. 30. Зависимость парциального давления водяного пара р 1 над водным раствором сахарозы от мольной доли воды в растворе
Пунктирная прямая на рис. 30 относится к идеальному раствору, подчиняющемуся закону Рауля. Зависимость давления пара от мольной доли растворителя для неидеального раствора (в данном случае раствора тростникового сахара) представлена непрерывной кривой, и показывает отклонение от закона Рауля. Повышение температуры кипения и понижение температуры замерзания водных растворов по сравнению с чистым растворителем является прямым следствием действия закона Рауля. Температура кипения отвечает такому состоянию системы, когда давление пузырьков пара кипящей жидкости становится равным внешнему (атмосферному) давлению. В открытом стакане температура кипения чистой воды равна 100 оС при атмосферном давлении р = 1 атм (1.013×105 Па). Температура замерзания (кристаллизации) воды при атмосферном давлении равна 0 оС. Если в кипящую воду бросить кристаллы сахарозы, то давление пара над водным раствором нелетучего вещества (сахарозы) уменьшится в соответствии с законом Рауля. Следовательно, раствор при температуре 100 0С перестанет кипеть. Потребуется увеличить температуру, чтобы увеличить давление пара воды над раствором и довести раствор до кипения. На фазовой диаграмме воды (рис. 31) линия ОC отражает фазовое равновесие жидкость ⇄ пар для чистой воды, а линия FD - для водного раствора нелетучего вещества. В точках C и D давление пара над чистым растворителем и над раствором равно внешнему давлению, равному 1 атм. Чистая вода закипает при 100 оС (373.15 К), а температура кипения раствора возрастает на величину DТ кип.. Для разбавленных растворов нелетучих веществ повышение температуры кипения прямо пропорционально количеству растворенного нелетучего вещества: DТ кип. = Э×сm, где Э [кг×К×моль-1] – эбулиоскопическая постоянная растворителя. Для воды она равна 0,51[кг×К×моль-1]; сm [моль/кг Н2О] – количество молей растворенного вещества в 1 кг воды.
Рис. 31. Фазовая диаграмма воды и водного раствора нелетучего вещества
По аналогии с предыдущим температура замерзания раствора ниже температуры кристаллизации чистого растворителя при постоянном внешнем давлении, равном 1 атм (рис. 31). Точка B на фазовой диаграмме соответствует температуре кристаллизации чистой воды (или плавления льда) при внешнем давлении, равном 1 атм. Точка А соответствует температуре появления кристаллов льда в растворе при 1 атм. Из диаграммы следует, что появление кристаллов льда в растворе происходит при более низкой температуре, чем в чистой воде на величину D Т кр. Для разбавленных растворов нелетучих веществ понижение температуры кристаллизации растворителя прямо пропорционально количеству растворенного нелетучего вещества: D Т кр = Ксm, где К [кг×К×моль-1] – криоскопическая постоянная растворителя, для воды она равна 1,86, сm [моль/кг Н2О] - количество молей растворенного вещества в 1 кг воды. Криоскопия и эбулиоскопия используются для определения молекулярной массы растворенного вещества в предельно разбавленных растворах.
Пример. Для определения молекулярной массы кристаллического порошка, который предположительно должен быть либо сахарозой, либо глюкозой, растворили 0.349 г этого неизвестного соединения в 100 г воды. Понижение температуры кристаллизации раствора составляет D Ткр = 0.036 К. Определить молекулярную массу соединения. Решение. сm = 0,349 1000/100 = 3,49, D Ткр = Ксm; 0.036 = 1.86×3.49/ М М = 1.86×3.49/0.036 = 180.3 г/моль. Молекулярные массы сахарозы и глюкозы соответственно равны 342.31 и 180.17 г/моль. Исследуемый нами порошок – глюкоза.
|
||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 427; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.85.96 (0.006 с.) |