Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Очистка (рафинирование) медиСодержание книги
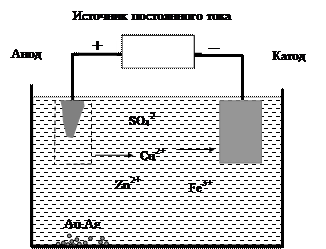
Поиск на нашем сайте При электролизе водных растворов с использованием металлических электродов анод может окисляться, если его окислительный потенциал выше потенциала воды. Например, медь окисляется легче, чем вода. Свойство металлических электродов участвовать в окислительно-восстановительных реакциях находит применение в процессах очистки металлов от примесей или покрытия одних металлов другими. Обычно медь в промышленности получают из сульфида меди по реакции: Cu2S(ж) + O2(г) ® 2Сu(ж) + SO2(г). Такая медь называется губчатой, она содержит до 1% примесей других металлов, главным образом железа, цинка, серебра и золота. Чтобы использовать медь для изготовления электротехнических изделий, проводят рафинирование (очистку) губчатой меди в электролизере (рис. 46). Анод делают из губчатой меди, катод из чистой меди. Электролитом служит водный раствор CuSO4 с добавлением небольшого количества серной кислоты. При электролизе медь анода растворяется, и чистая медь осаждается на катоде: анод (окисление): Cu(т)® Cu2+(р-р) + 2е-; катод (восстановление): Cu2+(р-р) + 2е- ® Cu(т). Золото и серебро окисляются труднее, чем медь, и в виде незначительных по массе частичек металлов собираются на дне электролизера. В растворе остаются ионы железа и цинка.
Рис. 46. Рафинирование меди
Покрытие одних металлов другими называется гальваническим покрытием или электроосаждением. При электроосаждении металл, который наносят на поверхность другого металла, выполняет роль анода. Например, если медные изделия покрывают слоем серебра, то анодом является серебряная пластина.
Краткий итог темы 1. Электролитами являются главным образом водные растворы солей, кислот, щелочей, а также расплавы солей. В отличие от металлов (электронная проводимость), электролиты проявляют ионную проводимость. 2. Сильные электролиты полностью распадаются в воде на ионы, слабые электролиты лишь частично диссоциируют на ионы при растворении в воде. Для сильного электролита степень диссоциации (a) равна или близка 1. Для слабых электролитов величина a существенно меньше 1. 3. Вода – слабый электролит. Ионное произведение воды (КW) при 25 оС, равное произведению концентраций ионов водорода и гидроксила сН+ сОН-,есть величина постоянная, равная 10-14. 4. Концентрацию ионов водорода принято выражать водородным показателем рН = -lg CH+. В кислой среде рН < 7, в щелочной рН > 7, в нейтральной рН = 7. 5. Ионные реакции, идущие с образованием нерастворимых в воде веществ, улетучивающихся газов или малодиссоциирующих соединений, являются необратимыми. 6. Реакции, протекающие с изменением степени окисления атомов, входящих в состав химических соединений, называются окислительно-восстановительными. Важно знать, что окислители в химических реакциях присоединяют электроны, а восстановители отдают электроны. 7. Гидролиз солей изменяет рН среды. Соли, образованные слабыми кислотами и сильными основаниями, при гидролизе создают щелочную среду; соли, образованные сильными кислотами и слабыми основаниями, – кислую среду. Соли сильных кислот и сильных оснований гидролизу не подвергаются. 8. Гальванические, топливные элементы и аккумуляторы служат источником электрической энергии. Они производятся в промышленных масштабах и служат источником энергии в электронных устройствах, в том числе на космических кораблях (топливные элементы), автомобилях (аккумуляторы). 9. В электролизерах электрическая энергия используется для получения вещества. Электролиз в промышленности используется для получения щелочных и щелочно-земельных металлов, алюминия, галогенов. Термины для запоминания Аккумуляторы - химические источники электрического тока многократного действия. Водородный показатель рН определяет концентрацию ионов водорода в данной среде и вычисляется как -lg CH+ Валентность численно равна количеству связей, образуемых элементом в соединении. Гальванические элементы - химические источники электрического тока, предназначенные для однократного (непрерывного или прерывистого) действия. Ионное произведение воды есть произведение концентраций ионов водорода и гидроксила сН+ сОН-, равное 1 10-14. Константа диссоциации электролита определяется отношением произведения равновесных концентраций катионов и анионов к равновесной концентрации недиссоциированных молекул. Окислительно-восстановительными называются реакции, протекающие с изменением степени окисления атомов, входящих в состав химических соединений. Реакция гидролиза- это взаимодействие ионов солей с водой, изменяющее рН среды с электронейтральной на кислую или щелочную. Реакция нейтрализации - взаимодействие кислоты с основанием с образованием соли и воды. Степень диссоциации (a) - отношение числа молекул электролита, распавшихся на ионы, к общему числу молекул растворенного электролита. Степень окисления – это условный воображаемый заряд атома в химическом соединении, который определяется, исходя из предположения, что соединение состоит из ионов. Стандартный электродный потенциал металла равен электродвижущей силе гальванического элемента, составленного из данного металлического электрода и стандартного водородного электрода. Ряд стандартных электродных потенциалов показывает, в какой последовательности восстанавливаются ионы металлов и окисляются простые вещества металлы. Электролиз – окислительно-восстановительный процесс, протекающий на электродах при пропускании постоянного электрического тока через раствор или расплав электролита. Электролизер – устройство, в котором электрическая энергия расходуется на проведение химической реакции. Электролитами называются жидкие или твердые вещества, которые в расплаве или в растворе способны распадаться на положительно и отрицательно заряженные ионы (катионы и анионы), способные перемещаться и проводить электрический ток. Электролитическая диссоциация - химический процесс взаимодействия электролита с растворителем, сопровождающийся образованием гидратированных (сольватированных) ионов.
Вопросы для проверки знаний 1. В чем различие электролитов и неэлектролитов? 2. Какой процесс называют электролитической диссоциацией? 3. По какому признаку разделяют электролиты на сильные и слабые? 4. Почему при растворении электролита раствор остается электронейтральным? 5. Изменяется ли степень диссоциации слабого электролита при уменьшении его концентрации в воде? 6. Можно ли утверждать, что на аноде всегда идут реакции окисления, а на катоде реакции восстановления? 7. Какой вид проводимости (ионная или электронная) осуществляется в растворе электролита? 8. Будет ли работать гальванический элемент без солевого мостика? 9. Чем отличается электролизер от гальванического элемента? 10. Какие два признака отличают электрохимическую реакцию от химической? 11. Какое численное значение имеет степень окисления простых веществ? 12. Гидролиз каких солей приводит к появлению в водном растворе ионов ОН-, ионов Н+? 13. Почему соли, образованные сильной кислотой и сильным основанием, в растворе не подвергаются гидролизу?
Упражнения 1. Для растворов следующих солей укажите реакцию среды: а) сульфат калия; б) нитрат меди (II); в) хлорид цинка; г) силикат натрия. Напишите сокращенные ионные уравнения первой ступени гидролиза. 2. При электролизе водного раствора NiSO4 использованы платиновые электроды. На катоде выделился никель, на аноде – газообразный кислород. Напишите уравнения реакций, протекающих на электродах, и объясните выделение этих продуктов. 3. Среди водных растворов солей Li2SO4, CuCl2, Ca(NO3)2, Na2SO4 выберите растворы, электролиз которых приводит к разложению воды. 4. Напишите уравнения реакций, сопровождающих электролиз водного раствора хлорида цинка. 5. Определите, какой газ выделился на катоде и аноде при электролизе водного раствора KCl. 6. Вычислите стандартную ЭДС гальванического элемента (-) Ni½NiSO4½½CuSO4½Cu (+), пользуясь таблицей стандартных электродных потенциалов.
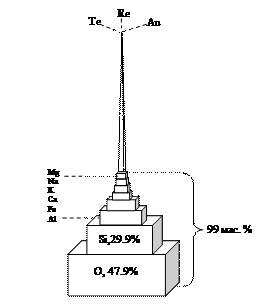
ТЕМА 5 МЕТАЛЛЫ Современной науке известно 111 элементов (включая полученные искусственно): 89 металлов и 22 неметалла. Среди химических элементов на долю 8 элементов приходится ~ 99% массы земной коры (табл. 9). Т а б л и ц а 9 Содержание основных элементов земной коры (по Ярошевскому)
Остальные элементы составляют всего 1 мас.% земной коры (рис. 47).
Рис. 47. Модель, демонстрирующая количественные соотношения химических элементов в земной коре (по Ярошевскому)
В табл. 10 приведены некоторые минералы горных пород. Т а б л и ц а 10
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 477; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.008 с.) |