Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Метод валентных связей (s- и p-связи), метод молекулярных орбиталей, гибридизация атомных орбиталей.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Для объяснения ковалентной связи используют 2 метода квантово-механического расчета: 1. 1.метод валентных связей (МВС) 2. 2.метод молекулярных орбиталей (ММО) Согласно методу валентных связей ковалентная связь образуется не путем передачи, а путем обобществления неспаренных электронов с антипараллельными спинами по 1-му от каждого атома. Образовавшаяся в этом случае электронная пара принадлежит обоим атомам. Чем в большей степени перекрываются атомные орбитали, тем прочнее связь. Перекрывание атомных орбиталей возможно лишь при их определенной взаимной ориентации в пространстве. Ковалентная связь в отличие от ионной имеет направленность. Атомные орбитали могут перекрываться двумя способами: 1-ый способ: перекрывание в направлении главных осей (осей, связывающих ядра).
Образовавшаяся при этом перекрывании ковалентная связь называется s-сигма связь. 2-ой способ: P-орбитали с параллельными осями.
Боковое перекрывание образует p-связь, менее прочную связь чем s- сигма. В соответствии с правилом Паули между двумя атомами может быть либо 1s-сигма связь, либо 1s-сигма и 1p-связь, либо 1s-сигма и 2p-связи.
64 64 64 обменнъiй механизм образования ковалентной связи (сигма-связь,пи-связь). При образовании ковалентной связи в молекулах органических соединений общая электронная пара заселяет связывающие молекулярные орбитали, имеющие более низкую энергию. В зависимости от формы МО – σ-МО или π-МО – образующиеся связи относят к σ- или p-типу. σ-Связь – ковалентная связь, образованная при перекрывании s-, p- и гибридных АО вдоль оси, соединяющей ядра связываемых атомов (т.е. при осевом перекрывании АО). π-Связь – ковалентная связь, возникающая при боковом перекрывании негибридных р-АО. Такое перекрывание происходит вне прямой, соединяющей ядра атомов.
π-Связи возникают между атомами, уже соединенными σ-связью (при этом образуются двойные и тройные ковалентные связи). π-Связь слабее σ-связи из-за менее полного перекрывания р-АО.
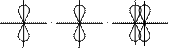
Различное строение σ- и π-молекулярных орбиталей определяет характерные особенности σ- и π-связей. 1. σ-Связь прочнее π-связи. Это обусловлено более эффективным осевым перекрыванием АО при образовании σ-МО и нахождением σ-электронов между ядрами. 2. По σ-связям возможно внутримолекулярное вращение атомов, т.к. форма σ-МО допускает такое вращение без разрыва связи (cм аним. Картинку внизу)). Вращение по двойной (σ + π) связи невозможно без разрыва π-связи! 3. Электроны на π-МО, находясь вне межъядерного пространства, обладают большей подвижностью по сравнению с σ-электронами. Поэтому поляризуемость π-связи значительно выше, чем σ-связи.
65 65 65 Щонорно-акцепторная связь. Механизм образования коваJIентной связи. Донорно-акцепторная связь, координационная связь, термин, обозначающий один из способов образования химической ковалентной связи. Обычная ковалентная связь между двумя атомами обусловлена взаимодействием двух электронов — по одному от каждого атома. Д.-а. с. осуществляется за счёт пары электронов одного атома (донора) и свободной (незаполненной) орбитали другого (акцептора). В обоих случаях электроны становятся общими для двух атомов. Типичным примером является образование иона аммония при реакции аммиака с ионом водорода (протоном): В молекуле аммиака азот имеет неподелённую пару электронов, у иона водорода 1s-орбиталь свободна. При достаточном сближении молекулы NH3 и иона Н+ двухэлектронное облако азота попадает в сферу притяжения иона водорода и становится общим и для атома азота, и для атома водорода, т. е. возникает четвёртая ковалентная связь N — Н. Все связи N — Н в этом ионе становятся равноценными и неразличимыми. Ещё один важный пример — образование иона оксония: В данном случае молекула воды — донор, протон — акцептор. Этот способ образования ковалентной связи играет большую роль в химии комплексных соединений. Механизмы образования ковалентных связей Различают несколько механизмов образования ковалентной связи: обменный (равноценный), донорно-акцепторный, дативный. При использовании обменного механизма образование связи рассматривается как результат спаривания спинов свободных электронов атомов. При этом осуществляется перекрывание двух атомных орбиталей соседних атомов, каждая из которых занята одним электроном. Таким образом, каждый из связываемых атомов выделяет для обобществления пары по электрону, как бы обмениваясь ими. например, при образовании молекулы трифторида бора из атомов три атомные орбитали бора, на каждой из которых имеется по одному электрону, перекрываются с тремя атомными орбиталями трех атомов фтора (на каждой из них также находится по одному неспаренному электрону). В результате спаривания электронов в областях перекрывания соответствующих атомных орбиталей появляется три пары электронов, связывающих атомы в молекулу. По донорно-акцепторному механизму перекрывается орбиталь с парой электронов одного атома и свободная орбиталь другого атома. В этом случае в области перекрывания также оказывается пара электронов. По донорно-акцепторному механизму происходит, например, присоединение фторид-иона к молекуле трифторида бора. Вакантная р-орбиталь бора (акцептора электронной пары) в молекуле BF3 перекрывается с р-орбиталью иона F−, выступающего в роли донора электронной пары. В образовавшемся ионе [BF4]− все четыре ковалентные связи бор−фтор равноценны по длине и энергии, несмотря на различие в механизме их образования. Атомы, внешняя электронная оболочка которых состоит только из s- и р-орбиталей, могут быть либо донорами, либо акцепторами электронной пары. Атомы, у которых внешняя электронная оболочка включает d-орбитали, могут выступать в роли и донора, и акцептора пар электронов. В этом случае рассматривается дативный механизм образования связи. Примером проявления дативного механизма при образования связи служит взаимодействие двух атомов хлора. Два атома хлора в молекуле Cl2 образуют ковалентную связь по обменному механизму, объединяя свои неспаренные 3р-электроны. Кроме того, происходит перекрывание 3р-орбитали атом Cl-1, на которой имеется пара электронов, и вакантной 3d-орбитали атома Cl-2, а также перекрывание 3р-орбитали атом Cl-2, на которой имеется пара электронов, и вакантной 3d-орбитали атома Cl-1. Действие дативного механизма приводит к увеличению прочности связи. Поэтому молекула Cl2 является более прочной, чем молекула F2, в которой ковалентная связь образуются только по обменному механизму: Молекулы F2 Cl2 Br2 I2 Энергия связи, кДж/моль 155 240 190 149
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 757; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.209.178 (0.009 с.) |

 Сl – Cl – обозначение ковалентной связи.
Сl – Cl – обозначение ковалентной связи.