Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Три основных свойства ковалентной связи (поляризуемость, насыщаемость, направленность).Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
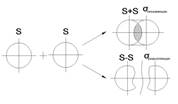
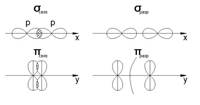
Поляризуемость–способность молекул поляризваться под влиянием внешнего электрического поля. Это может происходить и под влиянием поля, создаваемого приблизившейся полярной молекулой. Всегда важно учитывать полярность молекулы и ее электрический момент диполя. С последним связана реакционная способность веществ. Как правило, чем больше электрическиймомет диполя молекулы, тем выше реакционная способность вещества. С электрическим моментом диполя связана также растворимость вещества. Насыщаемость - способность атома образовывать столько ковалентных связей сколько у него имеется энергетически доступных атомных орбиталей. Направленность – определяет пространственную структуру молекул.Ковалентная связь направлена в сторону максимального перекрывания атомных орбиталей реагирующих атомов. 8) Образование σ- и π- связей (показать графически). Алгебраическая сумма и линейная комбинация 2-х S-орбиталей
Алгебраическая сумма и линейная комбинация 2-х P-орбиталей
Распределение электронов по молекулярным орбиталям происходит в соответствии с принципом «минимум энергии», т.е. электронами заполняются орбитали, которые имеют минимум энергии и которые являются очень прочными (связывающие орбитали) Переход электронов на молекулярные орбитали всегда способствует повышению энергии, и этот энергетический выигрыш равен энергии связи между атомами в молекуле 9) Метод молекулярных орбиталей (ММО). Основные положения. Понятия связывающей и разрыхляющей молекулярных орбиталей(на примере образования молекулы или иона). ММО позволяет представить как происходит распределение электронов по молекулярным орбиталям. В основе этого метода лежит представление о том, что все электроны данной молекулы или иона распределены по соответствующим молекулярным орбиталям. Описать молекулы по теории молекулярных орбиталей – это значит определить ее орбитали, их энергию и выяснить характер распределения электронов по орбиталям в порядке возрастания их энергии. Распределение электронов происходит в соответствии с принципом Паули и правилом Хунда, все молекулярные орбитали представляют в виде алгебраической суммы (линейной комбинации) атомных орбиталей. Молекулярные параметры (энергия связи, межъядерное расстояние, кратность связи). Молекулярные параметры (энергия связи, межъядерное расстояние, кратность связи). Длиной связи – межъядерным расстоянием между двумя химически связанными атомами. Энергией связи – количеством энергии, затрачиваемой на ее разрыв в газообразном состоянии. Распределение электронов по молекулярным орбиталям происходит в соответствии с принципом минимума энергии: электронами заполняются орбитали, которые имеют минимум энергии и которые являются очень прочными – это связь орбиталей. Переход на молекулярные орбитали всегда способствует понижению энергии системы и этот энергетический выигрыш равен энергии связи между атомами в молекуле. Кратностью связи – числом электронных пар, посредством которых осуществляется химическая связь между атомами. Согласно методу молекулярныхорбитаелей, возможно определить порядок или кратность связи n. Порядок определяется полуразностью числа связанных и разрыхленных электронов n= (Nсв-Nраз)/2.если кратность связи =0, то молекула не образуется. При наложении π -связи на σ-связь образуется двойная связь. Кратная связь изображается двумя черточками О=О, О=С=О. Суммарная энергия двойной связь выше одинарной, а длина двойной связи меньше длины одинарной. При наложении двух π-связей на σ-связь, например молекулы азота, оксида углерода, возникает тройная связь, изображается тремя черточками. Энергия тройной связи выше, а длина связи ниже, чем энергии и длины простой и двойной связи. Применение ММО к двухатомным гомоядерным молекулам. Энергетические диаграммы В2, С2, О2. Должны выполняться условия: АО должны иметь близкие энергии, перекрываться в значительной степени, иметь одинаовую симметрию относительно линий связи, число АО =числу МО. Применение ММО к двухатомным гетероядерным молекулам.Примеры. В случае гетероядерных молекул связывающей молекулярные орбитали, значительный вклад вносят атомы с большей электроотрицательностью. В этом случае связывающие орбитали по энергии ближе к орбиталям более электроотрицательного атома. В отличии от гомоядерных, гетероядерные молекулы образованы атомами с неодинаковыми зарядами атомов. Метод валентных связей (МВС). Основные положения теории МВС. Понятия гибридизации орбиталей (sp, sp2, sp3). Неподеленые электронные пары (искажение правильных геометрических фигур). Примеры NH3 и H2O. МВС иначе называют теорией локализованных электронных пар. Поскольку в основе метода лежит предположение о том, что химическая связь между двумя атомами осуществляется с помощью одной или нескольких электронных пар, которые находятся между этими атомами.В этом методе химическая связь всегда двухэлектронная и обязательно двухцентровая. Число элементарных химических связей, которые способен образовывать атом или ион, равно его валентности. Также как и в методе молекулярныхорбиталей, в образовании химической связи принимают участие валентные электроны. В соответствии с принципом Паули электроны должны иметь противоположно направленные спины. И в этом методе все электроны спарены, и поэтому молекулы все диамагнетики. Этот метод имеет ряд важных преимуществ: предсказывает валентные возможности атомов и геометрию образующейся молекулы. Последнее обстоятельство связано с так называемой гибридизацией атомных орбиталей (АО). Гибридизация была введена для объяснения того факта, что двухэлектронныедвухцентровые химические связи, образованные за счет АО в разных энергетических состояниях, имеют одинаковую энергию. Согласно представлению о гибридизации, химические связи образуются смешанными – гибридными орбиталями (ГО), которые представляют собой линейную комбинацию АО данного атома. Эти смешанные ГО обладают одинаковыми энергией и формой, определенной ориентацией в пространстве (симметрией).
S+p+p
По теории валентных связей один атом образует несколько связей, а его валентные электроны принадлежат разныморбиталям. Для объяснения геометрии молекул в МВС необходимо привлекать теорию гибридизации атомных орбиталей. Основные положения теории следующие: 1. Введение гибридных орбиталей служит для описания направленных локализованных связей. Гибридные орбитали обеспечивают максимальное перекрывание АО в направлении локализованных σ-связей. 2. Число гибридных орбиталей равно числу АО, участвующих в гибридизации. 3. Гибридизуются близкие по энергии валентные АО независимо от того, заполнены они в атоме полностью, наполовину или пусты. 4. В гибридизации участвуют АО, имеющие общие признаки симметрии. Правильные геометрические фигуры образуются, когда все периферические атомы в многоэлектронной молекуле (или ионе) одинаковы и их число совпадает с числом гибридных орбиталей. Если число гибридных орбиталей больше числа связанных атомов, то часть гибридных орбиталей заселена электронными парами, не участвующими в образовании связи.
В качестве примера рассмотрим молекулы NH3 и H2O. У азота, поимо трех связывающих пар электронов, образующих связь с тремя атомами водорода, остается одна несвязывающая пара. Она занимает гибриднуюорбиталь искажает угол связи и изменяет его значение.
|
||||
|
Последнее изменение этой страницы: 2016-08-01; просмотров: 648; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.49.59 (0.007 с.) |

 s-орбиталь + p-орбиталь и две sp-ГО
s-орбиталь + p-орбиталь и две sp-ГО sp2
sp2