
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Строение атомных ядер. Изотопьi.Содержание книги
Поиск на нашем сайте
1. Атом состоит из ядра и электронов. 2. Ядро заряжено положительно, а электроны отрицательно. 3. Ядро состоит из протонов и нейтронов. 4. Протон является носителем элементарного положительного заряда, равного по значению (1,6•10-19 Кл), но противоположного по знаку заряду электрона. Нейтрон заряда не имеет. Таким образом, заряд ядра (Z) равен числу протонов. Z=Np. 5. Число протонов определяет порядковый номер элемента. Общее название протонов и нейтронов — нуклоны. 6. Протоны и нейтроны имеют примерно одинаковые массы (mp=mn=1 а.е.м.). Масса атома определяется суммарным числом протонов и нейтронов, поскольку масса электрона в 2000 раз меньше массы протона. Сумма чисел протонов (Np) и нейтронов (N) определяет массовое число атома (А). 7. Электроны вращаются вокруг ядра. Число электронов равно числу протонов (атом электронейтрален). Принадлежность атома к какому-либо элементу определяется зарядом его ядра Z, т.е. числом протонов. При этом число нейтронов и, соответственно, массовое число у атомов одного и того же элемента может различаться. Такие атомы называются изотопами. Изотопами называют атомы с одинаковым зарядом ядра, но имеющие разные массовые числа. Таким образом, изотопы — это атомы одного элемента, имеющие разную массу. Каждый изотоп характеризуется двумя величинами: А (проставляется вверху слева от химического знака) и N (проставляется снизу слева от химического знака) и обозначается символом соответствующего элемента. Например: изотоп углерода 126C или словами: «углерод-12» Эта форма записи распространена на элементарные частицы: электронов, нейтрон 10n, протон 11p, нейтрино 00vi. Изотопы известны для всех химических элементов: кислород имеет изотопы с массовыми числами 16, 17, 18: 168О, 178O, 188O. Изотопы аргона: 3618Ar, 3818Ar, 4018Ar; калия: 3919K, 4019K, 4119K. Атомная масса элемента равна среднему значению из масс всех его природных изотопов с учетом распространенности их. Например, средняя атомная масса природного лития, содержащего 92,48% 73Li и 7,52% 63Li, равна 6,94 и т.д. Атомная масса элементов, приводимых в периодической системе Д. И. Менделеева, есть средние массовые числа природных смесей изотопов.
61 61 61 Периодический закон Менделеева. Периодическая таблица (периоды и группы). Периодический закон (1869 г.): свойства простых тел, а также свойства и формы соединений элементов находятся в периодической зависимости от величины атомных весов элементов. До появления сведений о сложном строении атома основной характеристикой элемента служил атомный вес (относительная атомная масса). Развитие теории строения атома привело к установлению того факта, что главной характеристикой атома является положительный заряд ядра. В современной формулировке периодический закон звучит: свойства химических элементов, а также формулы и свойства образуемых ими соединений находятся в периодической зависимости от величины заряда ядер их атомов. Физической основой структуры периодической системы элементов служит определённая последовательность формирования электронных конфигураций атомов по мере роста порядкового номера элемента. В зависимости от того, какой энергетический подуровень заполняется электронами последним, различают 4 типа элементов: 1. S – элементы (последним заполняется S -подуровень внешнего энергетического уровня) 2. p – элементы (последним заполняется p -подуровень внешнего энергетического уровня) 3. d – элементы (последним заполняется d -подуровень предпоследнего энергетического уровня) 4. f – элементы (последним заполняется f -подуровень 3-го снаружи энергетического уровня). Горизонтально располагаются периоды – последовательный ряд элементов, электронная конфигурация внешнего энергетического уровня которых изменяется от Вертикально располагаются группы – элементы имеющие сходное электронное строение. У элементов главной подгруппы последним заполняется
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 290; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.007 с.) |

 до
до  . Номер периода совпадает со значением главного квантового числа
. Номер периода совпадает со значением главного квантового числа 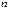 внешнего энергетического уровня.
внешнего энергетического уровня. и
и  подуровни внешнего энергетического уровня, у элементов побочной подгруппы происходит заполнение внутренних
подуровни внешнего энергетического уровня, у элементов побочной подгруппы происходит заполнение внутренних  и
и 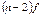 подуровней. Одинаковый номер группы, как правило, определяет число электронов, которое может участвовать в образовании химических связей.
подуровней. Одинаковый номер группы, как правило, определяет число электронов, которое может участвовать в образовании химических связей.


