
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
S-элементы группы 1А. Их общая характеристика.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
К s-элементам относят элементы IA-группы – щелочные металлы. Электронная формула валентной оболочки атомов щелочных металлов ns1. Устойчивая степень окисления равна +1. Элементы IА-группы обладают сходными свойствами из-за сходного строения электронной оболочки. При увеличении радиуса в группе Li-Fr связь валентного электрона с ядром слабеет и уменьшается энергия ионизации. Атомы щелочных элементов легко отдают свой валентный электрон, что характеризуют их как сильные восстановители. Восстановительные свойства усиливаются с возрастанием порядкового номера. Все элементы главных подгрупп I и II групп Периодической системы, а также водород и гелий, относят к s-элементам. Все они, кроме водорода и гелия, — металлы. Металлы I группы называют щелочными, так как они реагируют с водой, образуя щелочи. Металлы II группы, за исключением бериллия и магния, называют щелочноземельными. Франций, завершающий I группу, и радий, завершающий II группу, являются радиоактивными. Все s-металлы имеют во внешней оболочке по одному или два электрона, могут легко их отдавать, образуя ионы с устойчивыми конфигурациями благородных газов. Высокая восстановительная активность этих металлов проявляется в очень низких значениях их потенциалов (энергий) ионизации (ПИ) и электроотрицательностей
70 70 70 водород. Химические свойства. Полуление и использование водорода. Химические свойства водорода:
Получение и применение водорода Получение водорода: а) в промышленности 2H2O → электролиз → 2H2↑ + O2↑ 2NaCl + 2H2O → электролиз → 2H2 ↑ + Cl2 ↑ + 2NaOH H2O(пар) + C(кокс) H2 + CO б) в лаборатории Zn(т) + H2SO4(разб.) = ZnSO4 + H2 ↑ CaH2 + 2H2O = Ca(OH)2↓ + 2H2↑ Водород широко применяют при получении аммиака, хлороводорода, металлов, метанола, твердых жиров и других технически важных продукты. Использование и получение водорода Используется водород в производстве аммиака, метанола, хлороводорода, для гидрирования растительных жиров (при выработке маргарина), также для восстановления металлов (молибдена, вольфрама, индия) из оксидов. Водород-кислородным пламенем (3000°С) сваривают и режут тугоплавкие металлы и сплавы. Жидкий — служит ракетным топливом. При гидрогенизации угля и нефти бедные водородом низкосортные виды топлива превращаются в высококачественные. Водород используют для охлаждения мощных генераторов электрического тока, а его изотопы находят применение в атомной энергетике. В промышленности водород получают электролизом водных растворов солей (например, NaCl, Na2CO4), а также при конверсии твердого и газообразного топлива – угля и природного газа. Процессы конверсии протекают при температуре порядка 1000°С в присутствии катализаторов. Получаемая при этом газовая смесь называется синтез-газом.
71 71 71 S - элем енты гр. IIА. Их общая характеристика. В главную подгруппу II группы входят бериллий Be, магний Mg, кальций Са, стронций Sr, барий Ва, радий Ra. Из них кальций, стронций, барий относятся к семейству щелочноземельных металлов. Это s-элементы. В виде простых веществ типичные металлы. На внешнем уровне имеют по два электрона. Отдавая их, они проявляют в соединениях степень окисления +2. В окислительно-восстановительных реакциях все металлы подгруппы ведут себя как сильные восстановители, однако несколько более слабые, чем щелочные металлы. Это объясняется тем, что атомы металлов II группы имеют меньшие атомные радиусы, чем атомы соответствующих щелочных металлов, расположенных в тех же периодах. Это связано с некоторым сжатием электронных оболочек, так как s-подуровень внешнего электронного слоя у них завершен, поэтому электроны ими удерживаются сильнее. С ростом порядкового номера элемента отдача электронов облегчается, и поэтому металлические свойства закономерно возрастают. Более ярко они проявляются у щелочноземельных металлов. Следует отметить, что по своим свойствам бериллий и магний несколько отличаются от щелочноземельных металлов кальция, стронция и бария (последний элемент группы радий отличается от остальных щелочноземельных металлов природными радиоактивными свойствами). Кальций, стронций и барий окисляются на воздухе до оксидов состава RO, поэтому их хранят без доступа воздуха либо в герметически закрытых сосудах, либо под слоем эфира или керосина. Бериллий и магний при комнатной температуре на воздухе покрываются тонкой оксидной пленкой, предохраняющей их от дальнейшего окисления. Be, Mg, Ca, Sr, Ba, Ra – элементы II А группы, из них Ca, Sr, Ba, Ra – щелочноземельные металлы, т.к. их гидроксиды обладают щелочными свойствами. Из всех этих элементов только бериллий – является моноизотопным, все остальные полиизотопны. Радий – единственный элемент этой подгруппы, для которого неизвестно ни одного устойчивого изотопа. Все 14 изотопов радиоактивны и среди них наиболее устойчив 226Ra.
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 881; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.198.148 (0.006 с.) |

 восстановитель и с основными оксидами:
восстановитель и с основными оксидами:  (используют для восстановления цветных металлов).
(используют для восстановления цветных металлов).
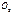 =
=  При поджигании соединение происходит мгновенно (гремучий газ)
При поджигании соединение происходит мгновенно (гремучий газ)


