Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Уровни структурной организации белковСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
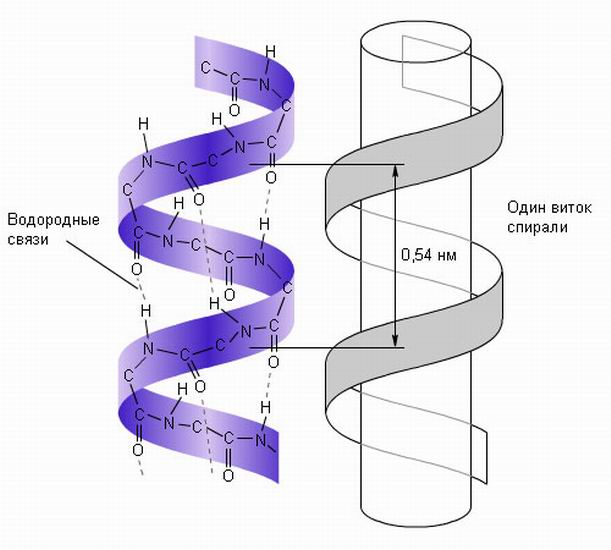
Первичная структура Первичной структурой называют последовательность аминокислотных остатков в полипептидной цепи. Она формируется в результате соединения L- α -аминокислот прочными пептидными связями. Каждый индивидуальный белок имеет уникальную последовательность аминокислот в цепи, то есть первичную структуру, которая закодирована в ДНК. Первичная структура специфически определяет более высокие уровни структурной организации: вторичную, третичную и четвертичную, то есть конформацию белковой молекулы. Даже небольшое изменение первичной структуры может значительно изменить свойства белка. Например, при врожденном нарушении структуры гемоглобина в эритроцитах содержится НbS, у которого в 6 положении вместо глутаминовой кислоты находится валин. HbS отличается по физико-химическим свойствам от НbА, у людей с такой аномалией проявляется серповидноклеточная анемия. Вторичная структура Вторичная структура белков – это конформация полипептидной цепи или ее пространственное расположение. Вторичная структура стабилизирована водородными связями, возникающими между функциональными группами –СО– и – NH– пептидных связей. Пептидная цепь стремится принять конформацию с максимальным числом водородных связей, так как ей соответствует минимум свободной энергии. Однако пространственное расположение полипептидной цепи ограничено плоскими жесткими пептидными связями, находящимися в транс-конформации. α -спираль. α-спираль, стабилизируется многочисленными внутрицепочечными водородными связями между NH-группой одного аминокислотного остатка и CO-группой четвертого от него остатка. Водородные связи располагаются вдоль оси α -спирали. α-спираль образуется самопроизвольно, т. к. является устойчивой конформацией, которой соответствует минимум свободной энергии.
Схематическое изображение α-спиральной конформации полипептидной цепи. Причины нарушения непрерывности α -спирали · Электростатическое отталкивание одноименно заряженных радикалов аминокислот; · близкое расположение объемных радикалов – механическая помеха; наличие в цепи пролина, который не способен образовывать водородную связь, т. к. он не имеет водорода у атома азота, участвующего в образовании пептидной связи β-структура β-структура (β-складчатый слой) имеет вид листа, сложенного «гармошкой», полипептидные цепи вытянуты, располагаются параллельно или антипараллельно. β-структура формируется за счёт водородных связей между СО– и NH–группами одной цепи, делающей изгиб или между разными полипептидными цепями. Водородные связи в β-структурах располагаются перпендикулярно полипептидным цепям. β-структура образуется самопроизвольно, т. к., подобно α-спирали, является устойчивой конформацией.
Первичная структура антипараллельного складчатого листка
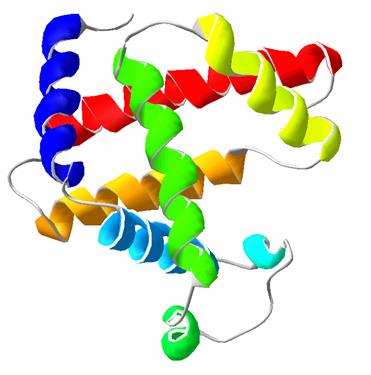
Содержание разных типов вторичных структур в белках неодинаково. Одни белки имеют много α -спирали, например, гемоглобин, миоглобин, тропомиозин. Другие белки имеют преимущественно β -структуры, например, иммуноглобулины и фермент супероксиддисмутаза. Многие белки содержат α -спирали и β -структуры: химиотрипсин (14% – α- спирали, 45% – β- структуры), рибонуклеаза (26% – α- спирали, 35% – β-структуры), лактатдегтдрогеназа (45% – α- спирали, 20% – β- структуры). В белковых молекулах существуют участки цепи, которые не относятся к регуляторной вторичной структуре, ни к α- спирали, ни к β- складчатому слою, их обозначают как неупорядоченные конформации (клубок). Однако, это не означает меньшую биологическую значимость таких участков. Для обеспечения биологического функционирования молекулы беспорядочные участки также важны, как и регуляторные структуры (α- спираль и β- складчатый слой). Задача У пациентов с болезнью Альцгеймера (один из самых распространенных видов деменции) происходит образование белковых агрегатов в мозге – нейрофибриллярных клубков и амилоидных бляшек. При исследовании аутопсийного материала, обнаруживается особенность – при окрашивании конго красным возникает зеленая флюоресценция в поляризованном свете. Какой вид вторичной структуры белка лежит в основе оптических свойств?
Ответ: характерное окрашивание амилоида обусловлено высокоупорядоченной β-складчатой структурой, перпендикулярной оси волокна. Третичная структура Третичная структура белков – это пространственная трехмерная структура или конформация, обусловленная межрадикальными взаимодействиями аминокислот, далеко стоящих друг от друга в полипептидной цепи. Третичная структура белковой молекулы является уникальной, специфичной и биологически активной. Образование нативной конформации белка происходит самопроизвольно, т. к. белок стремится образовать пространственно структуры с наименьшей свободной энергией. А информация о том, какой должна быть нативная трехмерная конформация полипептидной цепи заложена в аминокислотной последовательности, т. е. в первичной структуре. Белки обладают конформационной лабильностью, они способны к легким изменениям пространственной структуры за счёт разрыва одних и образования других слабых связей, принимающих участие в формировании биологически активной конформации. Подобные конформационные изменения необходимы для обеспечения функционирования белковых структур в организме. К слабым связям, которые обеспечивают конформационную лабильность белковых молекул, относятся ионные, водородные и гидрофобные взаимодействия, т. к. их энергия во много раз меньше, чем энергия ковалентной связи, даже при температуре тела человека возможен их разрыв и образование новых связей, но благодаря своей многочисленности они обеспечивают поддержание нативной конформации белка. Процесс укладки полипептидной цепи в пространстве с образованием биологически активных конформаций называют «фолдингом белков».
Четвертичная структура Четвертичной структурой обладают белки, состоящие из двух или более полипетидных цепей, соединенных нековалентными связями. Подобные белки называют олигомерами, а составляющие их индивидуальные цепи – протомерами, мономерами или субъединицами. Четвертичной структурой белка называют количество и взаимное расположение полипептидных цепей в пространстве с образованием нативной конформации олигомерного белка. Четвертичная структура также уникальна и специфична, как и другие уровни структурной организации. Субъединицы олигомерного белка соединяются в результате образования слабых взаимодействий: ионных, водородных и гидрофобных связей, которые принимали участие и в формировании третичной структуры.
Примером может служить гемоглобин, находящийся в эритроцитах, он содержит 4 субъдиницы: две α и две β цепи (является тетрамером). Олигомерные белки обладают особыми свойствами, которых нет у мономерных белков.
Задание. Составьте таблицу: «Уровни структурной организации белков» а) дайте определения первичной, вторичной, третичной и четвертичной структур. б) укажите функциональные группы, участвующие в стабилизации структур и укажите связи, их стабилизирующие. г) приведите примеры межрадикальных взаимодействийаминокислот.
Формы молекул белков могут быть различными. К глобулярным относят большинство белков, хорошо растворимых в воде (миоглобин, гемоглобин, альбумины, глобулины и др.). К фибриллярным относят фибрин, миозин, коллаген, эластин, кератин. Эти белки образуют межмолекулярные нитевидные комплексы (фибриллы), нерастворимые в воде. Трансмембранные белки содержат домен, пронизывающий мембрану, вне- и внутриклеточные домены. Многие белки-ионные каналы, транспортные белки, рецепторы гормонов и нейромедиаторов содержат похожие сегменты, пронизывающие мембранную часть, представляющие собой α-спираль с остатками гидрофобных аминокислот, обращенных к липидному окружению мембраны.
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 1167; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.9.183 (0.007 с.) |