
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация сложных белков.Содержание книги Поиск на нашем сайте
Гемопротеины: миоглобин и гемоглобин Гемсодержащие белки имеют чрезвычайно важное биологическое значение. Одни участвуют в процессах связывания и транспорта кислорода, другие осуществляют транспорт электронов в дыхательной цепи, проявляют ферментативную активность и являются участниками антиоксидантной защиты организма. Гемопротеины – это сложные белки, содержащие в качестве простетической группы, окрашенный в красный цвет гем – циклический тетрапиррол или протопорфирин, состоящий из 4-х пиррольных колец, соединенных метеновыми мостиками (=СН–) с образованием плоской кольцевой сопряженной системы, т. е. ароматической. Гем в молекулах гемоглобина и миоглобина содержит 2 винильных, 4 метильных и 2 пропионатные боковые цепи. В центре плоского кольца гема находится атом железа в ферросостоянии (
Основные гемсодержащие белки
Миоглобин Характеристика структуры · Миоглобин содержится в красных мышцах, относится к классу сложных белков, гемопротеинам, содержит белковую часть (апомиоглобин) и небелковую часть, простетическую группу – гем. Миоглобин является глобулярным белком, представлен одной полипептидной цепью, состоящей из 153 аминокислотных остатков. · Молекула миоглобина имеет высокую степень α- спирализации: почти 75% остатков образуют 8 правых α -спиралей, которые обозначают латинскими буквами, начиная от N-конца цепи: А, В, С, Д, Е, F, G, Н. · Пространственная 3-х мерная структура миоглобина имеет вид глобулы, образованной из α- спиралей за счет петель и изгибов цепи в области неспирализованных участков белка. В изгибах цепи находятся 4 остатка пролина. · Внутренняя часть глобулы миоглобина защищена от воды, т. к. содержит, в основном, неполярные гидрофобные радикалы аминокислот, за исключением 2-х остатков гистидина, располагающихся в активном центре, т. е. они пространственно сближены, но принадлежат различным спиралям – · Гем располагается в гидрофобном «кармане» между спиралями F и Е. Четыре связи атома железа с атомами пиррольных колец, пятое координа ционное положение атома железа занято атомом азота проксимального гистидина (Гис · Пространственная структура белковой глобулы вокруг гема обеспечивает прочное, но обратимое связывание с кислородом и устойчивость железа к окислению ( · Биологическая функция миоглобина: он не способен транспортировать кислород, но зато эффективно его запасает в красных мышцах. В условиях кислородного голодания, например, при сильной физической нагрузке кислород высвобождается из оксигенированного миоглобина и поступает в митохондрии мышечных клеток, где осуществляется синтез АТФ (окислительное фосфорилирование). Для миоглобина кривая адсорбции кислорода имеет форму гиперболы. Даже при низком парциальном давлении кислород в работающей мышце (20 мм рт. ст.) степень насыщения миоглобина кислородом составляет ~ 80%. Только при снижении рО2 до 5 мм рт. ст. (при кислородном голодании и тяжелой физической нагрузке) миоглобин легко отдает связанный кислород в митохондрии. Гемоглобин Отличие в структурах миоглобина и гемоглобина связано с тем, что гемоглобин имеет четвертичную структуру, которая наделяет его дополнительными свойствами, отсутствующими у миоглобина. Гемоглобин обладает аллостерическими свойствами (от греческого «аллос» – другой), его функционирование регулируется компонентами внутренней среды (кислород; Дезоксигемоглобин имеет жесткую, напряженную структуру, стабилизированную солевыми связями между субъединицами, т. е. Т-состояние (от англ. tense – напряжённый); центры связывания О2 малодоступны, сродство к О2 низкое. В отличие от миоглобина, который имеет трехмерную структуру, гемоглобины, находящиеся в эритроцитах, представляют собой тетрамерные белки, молекулы которых содержат различные типы субъединиц (α, β, γ). НbА – основной гемоглобин взрослого человека, олигомер, содержащий 2 α цепи (по 141 аминокислотному остатку в каждой цепи) и 2 β цепи (по 146 остатков, составляет ~ 98% от общего количества гемоглобина. Молекула гемоглобина имеет четыре гема, т. е. 4 центра связывания О2. Функции гемоглобина: · Транспорт О2 из легких к периферическим тканям; · Участие в транспорте СО2 и протонов от периферических тканей в легкие для последуюшего выведения из организма; · Буферное действие. Гемоглобиновая буферная система наиболее мощная из буферных систем крови, препятствует закислению среды в тканевых капиллярах и подщелачиванию в легких. Сходство и отличие структур миоглобина и гемоглобина А (НbА) Пространственные структуры (вторичная и третичная) отдельных цепей гемоглобина и миоглобина имеют поразительное сходство, несмотря на различия в аминокислотной последовательности в полипептидных цепях. Сходным является и расположение гема в гидрофобном «кармане» внутри белковой глобулы, его соединение с белком, а также расположение атома Итак, важнейшие акцепторы О2 в организме человека – миоглобин и гемоглобин имеют сходную конформацию, которая, по-видимому, обеспечивает им возможность обратимо связывать О2 и устойчивость к окислению. Связывание О2 сопровождается разрывом солевых связей между протомерами гемоглобина, что облегчает присоединение последующих молекул О2, т. к. центры связывания О2 открываются. Т-форма гемоглобина переходит в R-форму (relaxed – релаксированная), т. е. структура оксигемоглобина становится мягкой, сродство к О2 возрастает в 300 раз. Сродство гемоглобинов к О2 характеризуется величиной
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 1954; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.1.100 (0.006 с.) |

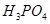 Гем
Гликозаминогликаны
Мn, Mg,
Гем
Гликозаминогликаны
Мn, Mg, 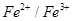 ,
, 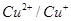 , Zn, Ca, K, Na
, Zn, Ca, K, Na
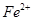 ), который образует четыре координационнные связи с азотами пиррольных колец, ещё две координационные связи возникают в плоскости перпендикулярной плоскости гема: пятая предназначена для связывания с полипептидной цепью (через азот пиридина), а шестая – для связывания физиологического лиганда – кислорода.
), который образует четыре координационнные связи с азотами пиррольных колец, ещё две координационные связи возникают в плоскости перпендикулярной плоскости гема: пятая предназначена для связывания с полипептидной цепью (через азот пиридина), а шестая – для связывания физиологического лиганда – кислорода.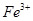 )
)
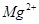 )
)
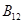 , цианкобаламин.
Содержит
, цианкобаламин.
Содержит 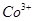 – металлопорфирин.
– металлопорфирин.
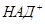 и
и 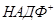 .
.
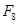 (проксимальный гистидин),
(проксимальный гистидин), 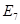 (дистальный гистидин).
(дистальный гистидин).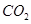 ;
;  ; 2,3-ДФГ), что способствует выполнению гемоглобином его важнейших биологических функций.
; 2,3-ДФГ), что способствует выполнению гемоглобином его важнейших биологических функций.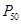 – значением парциального давления О2, при котором наблюдается полунасыщение гемоглобина кислородом. Чем ниже Р50, тем выше сродство к О2. Благодаря уникальной структуре гемоглобин присоединяет О2 в легких при его высоком насыщении кислородом (около 100%) и легко отдает О2 в капиллярах тканей при более низком давлении О2.
– значением парциального давления О2, при котором наблюдается полунасыщение гемоглобина кислородом. Чем ниже Р50, тем выше сродство к О2. Благодаря уникальной структуре гемоглобин присоединяет О2 в легких при его высоком насыщении кислородом (около 100%) и легко отдает О2 в капиллярах тканей при более низком давлении О2.


