Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Физиологически активные пептидыСодержание книги Поиск на нашем сайте Функции белков.
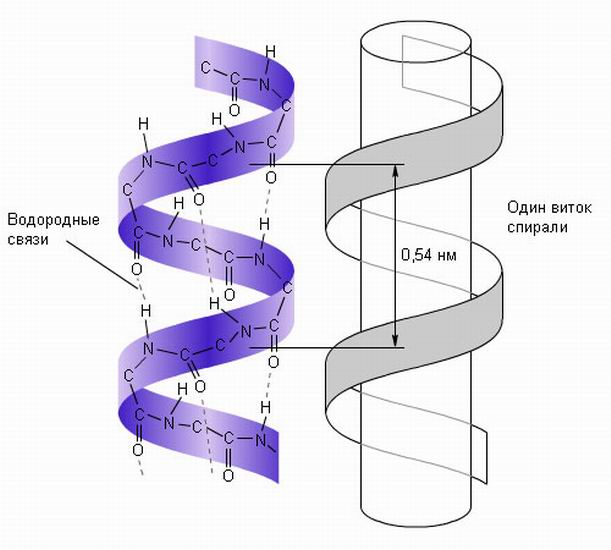
Уровни структурной организации белков Первичная структура Первичной структурой называют последовательность аминокислотных остатков в полипептидной цепи. Она формируется в результате соединения L- α -аминокислот прочными пептидными связями. Каждый индивидуальный белок имеет уникальную последовательность аминокислот в цепи, то есть первичную структуру, которая закодирована в ДНК. Первичная структура специфически определяет более высокие уровни структурной организации: вторичную, третичную и четвертичную, то есть конформацию белковой молекулы. Даже небольшое изменение первичной структуры может значительно изменить свойства белка. Например, при врожденном нарушении структуры гемоглобина в эритроцитах содержится НbS, у которого в 6 положении вместо глутаминовой кислоты находится валин. HbS отличается по физико-химическим свойствам от НbА, у людей с такой аномалией проявляется серповидноклеточная анемия. Вторичная структура Вторичная структура белков – это конформация полипептидной цепи или ее пространственное расположение. Вторичная структура стабилизирована водородными связями, возникающими между функциональными группами –СО– и – NH– пептидных связей. Пептидная цепь стремится принять конформацию с максимальным числом водородных связей, так как ей соответствует минимум свободной энергии. Однако пространственное расположение полипептидной цепи ограничено плоскими жесткими пептидными связями, находящимися в транс-конформации. α -спираль. α-спираль, стабилизируется многочисленными внутрицепочечными водородными связями между NH-группой одного аминокислотного остатка и CO-группой четвертого от него остатка. Водородные связи располагаются вдоль оси α -спирали. α-спираль образуется самопроизвольно, т. к. является устойчивой конформацией, которой соответствует минимум свободной энергии.
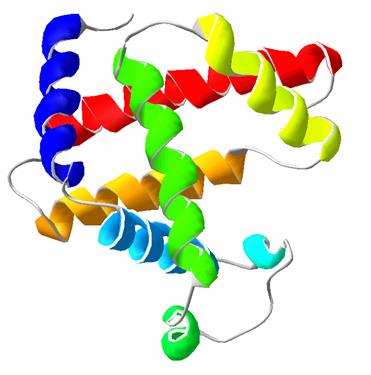
Схематическое изображение α-спиральной конформации полипептидной цепи. Причины нарушения непрерывности α -спирали · Электростатическое отталкивание одноименно заряженных радикалов аминокислот; · близкое расположение объемных радикалов – механическая помеха; наличие в цепи пролина, который не способен образовывать водородную связь, т. к. он не имеет водорода у атома азота, участвующего в образовании пептидной связи β-структура β-структура (β-складчатый слой) имеет вид листа, сложенного «гармошкой», полипептидные цепи вытянуты, располагаются параллельно или антипараллельно. β-структура формируется за счёт водородных связей между СО– и NH–группами одной цепи, делающей изгиб или между разными полипептидными цепями. Водородные связи в β-структурах располагаются перпендикулярно полипептидным цепям. β-структура образуется самопроизвольно, т. к., подобно α-спирали, является устойчивой конформацией.
Первичная структура антипараллельного складчатого листка
Содержание разных типов вторичных структур в белках неодинаково. Одни белки имеют много α -спирали, например, гемоглобин, миоглобин, тропомиозин. Другие белки имеют преимущественно β -структуры, например, иммуноглобулины и фермент супероксиддисмутаза. Многие белки содержат α -спирали и β -структуры: химиотрипсин (14% – α- спирали, 45% – β- структуры), рибонуклеаза (26% – α- спирали, 35% – β-структуры), лактатдегтдрогеназа (45% – α- спирали, 20% – β- структуры). В белковых молекулах существуют участки цепи, которые не относятся к регуляторной вторичной структуре, ни к α- спирали, ни к β- складчатому слою, их обозначают как неупорядоченные конформации (клубок). Однако, это не означает меньшую биологическую значимость таких участков. Для обеспечения биологического функционирования молекулы беспорядочные участки также важны, как и регуляторные структуры (α- спираль и β- складчатый слой). Задача У пациентов с болезнью Альцгеймера (один из самых распространенных видов деменции) происходит образование белковых агрегатов в мозге – нейрофибриллярных клубков и амилоидных бляшек. При исследовании аутопсийного материала, обнаруживается особенность – при окрашивании конго красным возникает зеленая флюоресценция в поляризованном свете. Какой вид вторичной структуры белка лежит в основе оптических свойств?
Ответ: характерное окрашивание амилоида обусловлено высокоупорядоченной β-складчатой структурой, перпендикулярной оси волокна. Третичная структура Третичная структура белков – это пространственная трехмерная структура или конформация, обусловленная межрадикальными взаимодействиями аминокислот, далеко стоящих друг от друга в полипептидной цепи. Третичная структура белковой молекулы является уникальной, специфичной и биологически активной. Образование нативной конформации белка происходит самопроизвольно, т. к. белок стремится образовать пространственно структуры с наименьшей свободной энергией. А информация о том, какой должна быть нативная трехмерная конформация полипептидной цепи заложена в аминокислотной последовательности, т. е. в первичной структуре. Белки обладают конформационной лабильностью, они способны к легким изменениям пространственной структуры за счёт разрыва одних и образования других слабых связей, принимающих участие в формировании биологически активной конформации. Подобные конформационные изменения необходимы для обеспечения функционирования белковых структур в организме. К слабым связям, которые обеспечивают конформационную лабильность белковых молекул, относятся ионные, водородные и гидрофобные взаимодействия, т. к. их энергия во много раз меньше, чем энергия ковалентной связи, даже при температуре тела человека возможен их разрыв и образование новых связей, но благодаря своей многочисленности они обеспечивают поддержание нативной конформации белка. Процесс укладки полипептидной цепи в пространстве с образованием биологически активных конформаций называют «фолдингом белков».
Четвертичная структура Четвертичной структурой обладают белки, состоящие из двух или более полипетидных цепей, соединенных нековалентными связями. Подобные белки называют олигомерами, а составляющие их индивидуальные цепи – протомерами, мономерами или субъединицами. Четвертичной структурой белка называют количество и взаимное расположение полипептидных цепей в пространстве с образованием нативной конформации олигомерного белка. Четвертичная структура также уникальна и специфична, как и другие уровни структурной организации. Субъединицы олигомерного белка соединяются в результате образования слабых взаимодействий: ионных, водородных и гидрофобных связей, которые принимали участие и в формировании третичной структуры.
Примером может служить гемоглобин, находящийся в эритроцитах, он содержит 4 субъдиницы: две α и две β цепи (является тетрамером). Олигомерные белки обладают особыми свойствами, которых нет у мономерных белков.
Задание. Составьте таблицу: «Уровни структурной организации белков» а) дайте определения первичной, вторичной, третичной и четвертичной структур. б) укажите функциональные группы, участвующие в стабилизации структур и укажите связи, их стабилизирующие. г) приведите примеры межрадикальных взаимодействийаминокислот.
Формы молекул белков могут быть различными. К глобулярным относят большинство белков, хорошо растворимых в воде (миоглобин, гемоглобин, альбумины, глобулины и др.). К фибриллярным относят фибрин, миозин, коллаген, эластин, кератин. Эти белки образуют межмолекулярные нитевидные комплексы (фибриллы), нерастворимые в воде. Трансмембранные белки содержат домен, пронизывающий мембрану, вне- и внутриклеточные домены. Многие белки-ионные каналы, транспортные белки, рецепторы гормонов и нейромедиаторов содержат похожие сегменты, пронизывающие мембранную часть, представляющие собой α-спираль с остатками гидрофобных аминокислот, обращенных к липидному окружению мембраны. Классификация белков По составу:
Простые Сложные Содержат только содержат белковую часть (апопротеин) аминокислоты и небелковый компонент
Небелковый компонент сложных белков может быть представлен различными веществами. Миоглобин Характеристика структуры · Миоглобин содержится в красных мышцах, относится к классу сложных белков, гемопротеинам, содержит белковую часть (апомиоглобин) и небелковую часть, простетическую группу – гем. Миоглобин является глобулярным белком, представлен одной полипептидной цепью, состоящей из 153 аминокислотных остатков. · Молекула миоглобина имеет высокую степень α- спирализации: почти 75% остатков образуют 8 правых α -спиралей, которые обозначают латинскими буквами, начиная от N-конца цепи: А, В, С, Д, Е, F, G, Н. · Пространственная 3-х мерная структура миоглобина имеет вид глобулы, образованной из α- спиралей за счет петель и изгибов цепи в области неспирализованных участков белка. В изгибах цепи находятся 4 остатка пролина. · Внутренняя часть глобулы миоглобина защищена от воды, т. к. содержит, в основном, неполярные гидрофобные радикалы аминокислот, за исключением 2-х остатков гистидина, располагающихся в активном центре, т. е. они пространственно сближены, но принадлежат различным спиралям – · Гем располагается в гидрофобном «кармане» между спиралями F и Е. Четыре связи атома железа с атомами пиррольных колец, пятое координа ционное положение атома железа занято атомом азота проксимального гистидина (Гис · Пространственная структура белковой глобулы вокруг гема обеспечивает прочное, но обратимое связывание с кислородом и устойчивость железа к окислению ( · Биологическая функция миоглобина: он не способен транспортировать кислород, но зато эффективно его запасает в красных мышцах. В условиях кислородного голодания, например, при сильной физической нагрузке кислород высвобождается из оксигенированного миоглобина и поступает в митохондрии мышечных клеток, где осуществляется синтез АТФ (окислительное фосфорилирование). Для миоглобина кривая адсорбции кислорода имеет форму гиперболы. Даже при низком парциальном давлении кислород в работающей мышце (20 мм рт. ст.) степень насыщения миоглобина кислородом составляет ~ 80%. Только при снижении рО2 до 5 мм рт. ст. (при кислородном голодании и тяжелой физической нагрузке) миоглобин легко отдает связанный кислород в митохондрии. Гемоглобин Отличие в структурах миоглобина и гемоглобина связано с тем, что гемоглобин имеет четвертичную структуру, которая наделяет его дополнительными свойствами, отсутствующими у миоглобина. Гемоглобин обладает аллостерическими свойствами (от греческого «аллос» – другой), его функционирование регулируется компонентами внутренней среды (кислород; Дезоксигемоглобин имеет жесткую, напряженную структуру, стабилизированную солевыми связями между субъединицами, т. е. Т-состояние (от англ. tense – напряжённый); центры связывания О2 малодоступны, сродство к О2 низкое. В отличие от миоглобина, который имеет трехмерную структуру, гемоглобины, находящиеся в эритроцитах, представляют собой тетрамерные белки, молекулы которых содержат различные типы субъединиц (α, β, γ). НbА – основной гемоглобин взрослого человека, олигомер, содержащий 2 α цепи (по 141 аминокислотному остатку в каждой цепи) и 2 β цепи (по 146 остатков, составляет ~ 98% от общего количества гемоглобина. Молекула гемоглобина имеет четыре гема, т. е. 4 центра связывания О2. Функции гемоглобина: · Транспорт О2 из легких к периферическим тканям; · Участие в транспорте СО2 и протонов от периферических тканей в легкие для последуюшего выведения из организма; · Буферное действие. Гемоглобиновая буферная система наиболее мощная из буферных систем крови, препятствует закислению среды в тканевых капиллярах и подщелачиванию в легких. Сходство и отличие структур миоглобина и гемоглобина А (НbА) Пространственные структуры (вторичная и третичная) отдельных цепей гемоглобина и миоглобина имеют поразительное сходство, несмотря на различия в аминокислотной последовательности в полипептидных цепях. Сходным является и расположение гема в гидрофобном «кармане» внутри белковой глобулы, его соединение с белком, а также расположение атома Итак, важнейшие акцепторы О2 в организме человека – миоглобин и гемоглобин имеют сходную конформацию, которая, по-видимому, обеспечивает им возможность обратимо связывать О2 и устойчивость к окислению. Связывание О2 сопровождается разрывом солевых связей между протомерами гемоглобина, что облегчает присоединение последующих молекул О2, т. к. центры связывания О2 открываются. Т-форма гемоглобина переходит в R-форму (relaxed – релаксированная), т. е. структура оксигемоглобина становится мягкой, сродство к О2 возрастает в 300 раз. Сродство гемоглобинов к О2 характеризуется величиной Эффект Бора Гемоглобин не только переносит О2 от легких к периферическим тканям, но и ускоряет транспорт СО2 и протонов от тканей к легким. Эффект Бора – это влияние концентрации СО2 и Н+ на сродство гемоглобина к О2. Увеличение концентрации протонов и СО2 снижает сродство О2 к гемоглобину и усиливает транспорт О2 в ткани. Разные органы потребляют неодинаковые количества кислорода. Наиболее активно извлекают кислород из крови работающие мышцы (до 85%). Если гемоглобин насыщен кислородом почти на 100%, то все молекулы гемоглобина находятся в R-форме, Нb(О2)4. Такое состояние гемоглобина возникает при высоком парциальном О2 в капиллярах легких (100 мм рт. ст.) и при высоком сродстве Нb к О2. В капиллярах мышц и других тканей более низкое парциальное давление О2, в этих условиях от гемоглобина могут отщепляться молекулы О2 и поступать в ткани. Например, при парциальном давлении кислорода в капиллярах 40 мм рт. ст. гемоглобин имеет насыщение ≈ 65%. Далее действуют другие факторы, приводящие к снижению сродства гемоглобина к О2, тем самым увеличивая доставку кислорода в ткани: а) гемоглобин протонируется, связывая три пары Н+ в пептидных цепях гемоглобина, вновь формируется Т-структура; б) гемоглобин обратимо присоединяет часть СО2 (до 15%) к концевым аминогруппам пептидных цепей, образуется карбогемоглобин: R-NH-COO- +Н+, где R-белковая цепь гемоглобина. Это также снижает сродство гемоглобина к О2. Большая часть СО2 транспортируется кровью в виде бикарбоната НСО3 -. Таким образом, диоксид углерода, образовавшийся в тканях реагирует с водой, образуя угольную кислоту, которая диссоциирует на бикарбонат- ион и Н+. Синтез углекислоты, как и её разложение на СО2 и Н2О происходит при участии фермента карбоангидразы. В периферических тканях гемоглобин отдает О2, сам протонируется и связывает часть СО2, его R-форма переходит в Т-форму, сродство к О2 резко снижается. В легких происходят обратные процессы. Фетальный гемоглобин С фетальным гемоглобином (НbF) или гемоглобином плода 2,3-БФГ связывается менее прочно, чем с гемоглобином взрослого человека (НbА). это объясняется тем, что в аллостерическом центре γ- цепей (β- подобный) для связывания 2,3-БФГ находится не Гис 143, а Сер, который не участвует в образовании ионных связей, поэтому HbF стабилизируется бифосфоглицератом в меньшей степени и обладает большим сродством к О2, чем НbА. Такое свойство НbF объяснимо с физиологической точки зрения, т. к. оно обеспечивает направленный транспорт О2 из крови матери в кровь плода.
Блок обучающих заданий. Тема заданий: Сложные белки. Гемопротеины. Задание Заполните таблицу: «Классификация сложных белков»
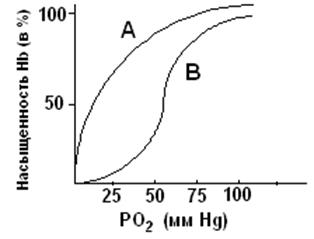
Задание. Подберите к белкам (1-8) соответствующий класс (А,Б,В) 1.Рецепторы мембран 2.Иммуноглобулины А. Нуклеопротеины 3.РНК-протеин 4. Каталаза Б. Гемопротеины 5. Миоглобин 6. Гемоглобин В. Гликопротеины 7. Цитохромы 8. Хлорофилл Задание. Знайте сравнительную характеристику структуры и свойств гемоглобина и миоглобина. Для этого обратите внимание на следующее: а) оба белка являются гемопротеинами и способны обратимо связывать кислород. Гемоглобин присоединяет кислород из альвеолярного воздуха и с кровотоком доставляет его в ткани, миоглобин акцептирует кислород, доставленный гемоглобином, запасает кислород в тканях и транспортирует внутри клетки в митохондрии. б) гемоглобин в отличие от миоглобина является олигомерным белком, его молекула содержит 4 субъединицы (a2b2), т.е. Нb обладает более высоким конформационным уровнем. в) функционирование гемоглобина, в отличие от миоглобина, регулируется компонентами внутренней среды (Н+, СО2, 2,3-БФГ) Задание. Рассмотрите кривые насыщения кислородом для миоглобина и гемоглобина. На оси абсцисс отмечены значения рО2, характерные для работающей мышцы и для альвеол легких. а) обратите внимание на 2 отличия: во-первых при любом значении рО2 насыщение миоглобина кислородом выше (А), чем НЬ (Б), во-вторых кривая диссоциации кислорода миоглобином имеет форму гиперболы, а кривая диссоциации НЬ – S – образную, которая отражает кооперативные изменения в молекуле НЬ при взаимодействии с кислородом. Кривые насыщения (диссоциации) кислорода для миоглобина и гемоглобина. При возрастании давления кислорода крутизна кривой увеличивается, отражая увеличение сродства к кислороду частично оксигенированного гемоглобина. б) при каком парциальном давлении кислорода Мb и Нb имеют 50% насыщения (Р50 )?
в) по графику определите степень насышения Нb и Мb в условиях А, Б и В
Сделайте заключение о том, какой из акцепторов кислорода обладает большим сродством к кислороду? Ответ......
Ответьте на вопрос: Какой из акцепторов кислорода очень эффективно отдает кислород в тканях.? Ответ.....
Задание. Сравните две формы Нb (дезоксигемоглобин и оксигемоглобин), правильно расположив в таблице следующие их характеристики: жесткая структура, напряженная структура, расслабленная структура, мягкая структура, Т-форма, R-форма, высокое сродство к О2, низкое сродство к О2
Задание 8. Рассмотрите схему, иллюстрирующую эффект Бора а) закончите фразу: «Эффект Бора – это влияние..... на связывание... гемоглобином. б) укажите на схеме 1) - локализацию процессов А и Б ---- 2) – формы НЬ (С --... и Д --...) 3) – фермент Е
А С Б НЬ 4О2
Ї Ї 2Н2СО3 2Н2СО3 Ї Е -? Ї Е -?
? Д катаболизм Решите задачу: Представление об аллостерическом взаимодействии 2,3-бифосфоглицерата (2,3-БФГ) с гемоглобином. Рассмотрите рисунок: Связь 2,3-БФГ с дезоксигемоглобином.
О--------------------Е ГИС (2) В аллостерическом центре │ О = С О----------Е ЛИЗ (82) b-цепей НЬ три Е заряжен-
С - О - Р = О ные группы │ │ Н С Н О │ О │
║ -О О О- --------------Е ГИС (143) Получите представление о физиологической роль 2,3-БФГ.
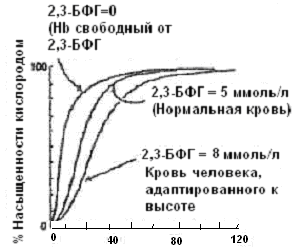
а) рассмотрите рисунок и обратите внимание на то что 2,3БФГ снижает сродство Нb к кислороду в 26 раз: Р50 для Нb без БФГ – 1 мм рт ст Р50 для Нb с БФГ – 26 мм рт ст Из этого следует, что 2,3БФГ играет очень важную роль в физиологии дыхания. В отсутствии 2,3БФГ гемоглобин проходя через капилляры тканей (рСО2 ~ 26 мм рт ст) высвобождал бы очень мало кислорода. Некоторых адаптивные механизмы, включающиеся при нарушении снабжения тканей кислородом. 1. Больные, у которых затруднено поступление воздуха в альвеолы. В результате этого рО2 в артериальной крови составляет 50 мм рт ст, т.е. вдвое ниже нормы. Однако, при этом происходит компенсаторный сдвиг в насыщении кислородом, обусловленный изменением концентрации БФГ в периферических тканях в сторону.. При новом содержании БФГ, Р50 НЬ составляет уже не 26, а 31 мм рт ст и сродство НЬ к кислороду при этом..., а доставка кислорода в ткани..... 2. Адаптация к высоте. Когда человек поднимается на высоту 5000 м, насыщение артериальной крови кислородом уменьшается, Р50 снижается. Но постепенно (через 2-3 дня) концентрация БФГ возрастает с 4,5 до 7,0 ммоль и сродство НЬ к кислороду соответственно...В результате этого в капиллярной сети периферических тканей кислорода высвобождается...... При спуске с гор парциальное давление кислорода в атмосферном воздухе повышается и концентрация БФГ возврашается к исходным величинам. 3. Гемоглобин плода НbF, характеризуется более высоким сродством к кислороду, по сравнению с НbА (взрослого человека). Это отличие создает оптимальные условия для транспорта кислорода из крови матери в кровь плода. НbF оксигенируется за счет НbА, находящегося по другую сторону трансплацентарного барьера в кровеносной системе плаценты.
Дополните фразу: НbF связывает 2,3БФГ (слабее, сильнее) чем НbА и, следовательно, обладает более высоким
сродством к О2.
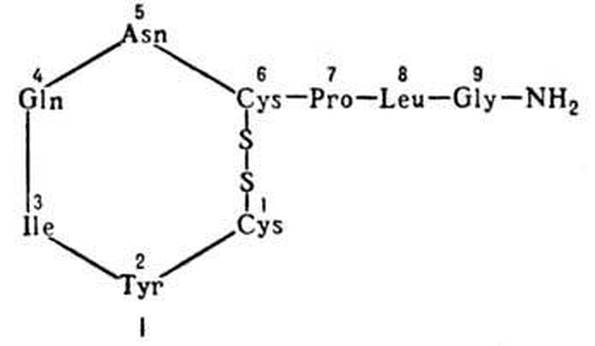
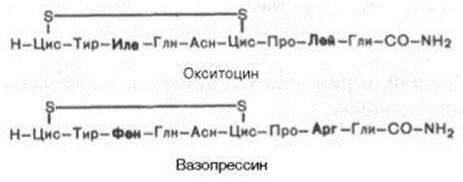
Рассмотрите график и укажите, какому типу гемоглобина (А или F) соответствует каждая кривая. Задача. Впервые поднявшись высоко в горы, пациент испытал приступ болей в конечностях, схожий с кризами, периодически испытываемыми его братом, больным серповидно-клеточной анемией. Ранее подобных проявлений у пациента не отмечалось. Объясните возможные биохимические механизмы, лежащие в основе данного состояния. Ответ: У гетерозиготных носителей серповидно-клеточности чаще всего патология не проявляется. Однако в случае резкой гипоксии и дегидратации, дезоксигенированная форма HbS полимеризуется, формируя серповидно-клеточные эритроциты. Физиологически активные пептиды Организм человека продуцирует множество разных пептидов высокой физиологической активностью. К ним относятся: 1. группа пептидов, обладающих гормональной активностью; 2. низкомолекулярные пептиды, принимающие участие в процессах переваривания (гастрин, секретин, холецистокинин); 3. вазоактивные пептиды (ангиотензин, брадикинин); 4. пептиды, влияющие на аппетит (лептин, нейропептид Y); 5. нейропептиды (опиоиды). Многие пептиды из указанных выше групп содержат в первичной структуре пептидные связи, образованные α -амино- и α -карбоксильной группами L- α -аминокислот, входящих в состав белков. Приведём несколько примеров. Гормоны окситоцин и вазопрессин являются нонапептидами, то есть содержат по 9 аминокислотных остатков, из которых только 2 не идентичны (в 3 и 8 положениях), кроме того, у этих гормонов совпадает последовательность аминокислот в полипептидной цепи. Однако функции у гормонов различны. Окситоцин вызывает сокращение гладкой мускулатуры матки при родах, усиливает лактацию в молочной железе при кормлении ребёнка. Вазопрессин увеличивает резорбцию воды в почках; поэтому его ещё называют антидиуретическим гормоном (АДГ).
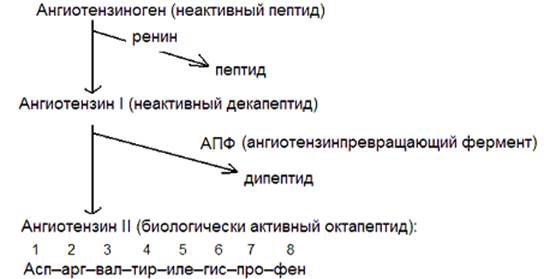
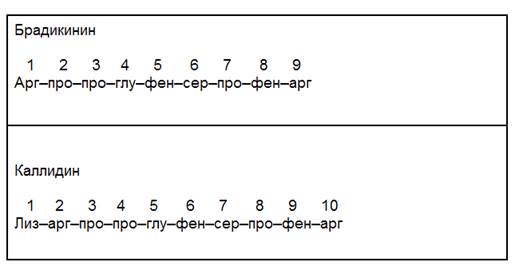
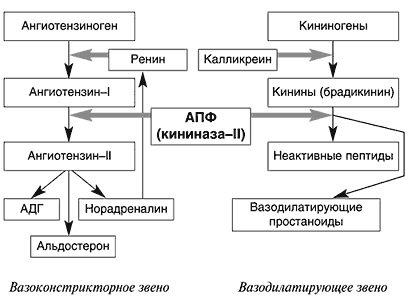
Вазоактивные пептиды – ангиотензин II, брадикинин, каллидин, атриопептиды – влияют на тонус сосудов. Образуются в плазме крови из неактивных белков-предшественников, в которых специальные протеазы расщепляют пептидные связи ограниченным протеолизом.
Рис. Образование ангиотензина II. Физиологическое действие – сокращает сосуды (вазоконстрикция), регуляция артериального давления и водно-солевого обмена.
Рис Брадикинин и каллидин. Физиологическое действие – оба пептида вызывают расслабление гладких мышц сосудов (вазодилатация).
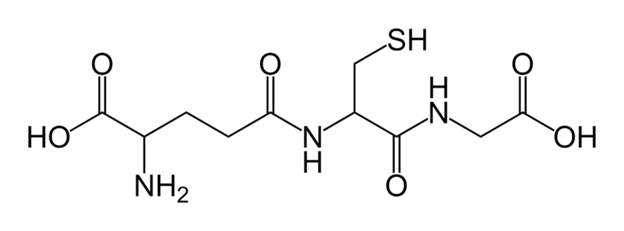
Атриопептиды (от лат. аtrio – предсердие) – пептиды, вырабатываемые кардиомиоцитами предсердий. Предсердный натрийуретический фактор (ПНФ) или гормон. Содержит 28 аминокислотных остатков, образуется из неактивного прогормона, состоящего из 126 аминокислот. Физиологические эффекты – в периферических артериях снижает тонус гладких мышц, расширяет артериолы и снижает артериальное давление, а в почечных канальцах стимулирует экскрецию (выведение) ионов натрия. Атипичный трипептид глутатион. Широко распространён в организме человека. Он содержит необычную пептидную связь, которая образуется между глутаматом и цистеином не через α -COOH группу, а через R-COOH-группу глутамата (рис.4)
Рис.4. Глутатион (γ-глу-цис-гли).
Глутатион необходим для работы ряда ферментов, осуществляет антиоксидантную защиту в организме, способен обратимо переходить из окисленной формы (Г–S–S–Г) в восстановленную (Г–SH) и может использоваться в окислительно-восстановительных процессах как донор и акцептор водорода:
Пептиды нервной ткани – нейропептиды – обладают широким спектром биологического действия. Многие из них функционируют как медиаторы и как гормоны, другие (энкефалины и эндорфины) способствуют аналгезии, то есть снижению болевых ощущений. Энкефалины и эндорфины относятся к опиоидам, так как воздействуют на центральную нервную систему через опиатные рецепторы, которые являются центрами связывания опиатов (морфина и других). Нейропептиды участвуют в регуляции высшей нервной деятельности, в биохимических механизмах процессов обучения, памяти, сна, возникновения страха, чувства голода, воздействуют на центры, ответственные за эмоции. Эти пептиды образуются путём ограниченного протеолиза неактивного белка-предшественника. Например, пептид β -липотропин – гормон гипофиза – известен тем, что в небольшой мере стимулирует липолиз в жировой ткани, однако главная физиологическая функция β -липотропина связана с появлением биологически активных нейропептидов при его частичном протеолизе. Интерес к природным пептидам в значительной степени обусловлен тем, что они оказывают мощное фармакологическое действие на многие физиологические реакции организма. В то же время была замечена их низкая стабильность при физиологических значениях рН. Использование пептидов в лечебных целях ограничено их быстрым разрушением в организме, и поэтому современным направлением в их исследовании является не только выделение и изучение структуры пептидов, но и попытки синтеза аналогов природных пептидов, защищённых от действия тканевых протеаз, способных к пролонгированному действию и не вызывающих привыкания. Задание Ангиотензинпревращающий фермент участвует в образовании ангиотензина II и в разрушении брадикинина. В качестве лекарственных препаратов, используются ингибиторы ангиотензинпревращающего фермента (каптоприл, эналаприл и др.). Исходя из биологических эффектов ангиотензина II и брадикинина, предположите эффект таких препаратов. Ответ: В основе действия препаратов ингибиторов АПФ лежит уменьшение образования сосудосуживающего октапептида – ангиотензина II и уменьшение разрушения пептида брадикинина, который расширяет сосуды, снижает артериальное давление.
В плазме крови находится белок ангиотензиноген, от которого под действием протеолитического фермента ренина отщепляется ангиотензин I – неактивный декапептид. АПФ отщепляет с С-конца ангиотензина I две аминокислоты, в результате чего образуется октапептид ангиотензин II, регулирующий водно-солевой обмен в организме и обладающий сильным сосудосуживающим влиянием.
Кинины (брадикинин, каллидин, Т-кинин и др.)
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 2677; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.102 (0.041 с.) |





 Белки
Белки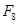 (проксимальный гистидин),
(проксимальный гистидин), 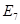 (дистальный гистидин).
(дистальный гистидин).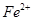 в
в 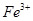 ).
).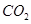 ;
;  ; 2,3-ДФГ), что способствует выполнению гемоглобином его важнейших биологических функций.
; 2,3-ДФГ), что способствует выполнению гемоглобином его важнейших биологических функций.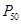 – значением парциального давления О2, при котором наблюдается полунасыщение гемоглобина кислородом. Чем ниже Р50, тем выше сродство к О2. Благодаря уникальной структуре гемоглобин присоединяет О2 в легких при его высоком насыщении кислородом (около 100%) и легко отдает О2 в капиллярах тканей при более низком давлении О2.
– значением парциального давления О2, при котором наблюдается полунасыщение гемоглобина кислородом. Чем ниже Р50, тем выше сродство к О2. Благодаря уникальной структуре гемоглобин присоединяет О2 в легких при его высоком насыщении кислородом (около 100%) и легко отдает О2 в капиллярах тканей при более низком давлении О2.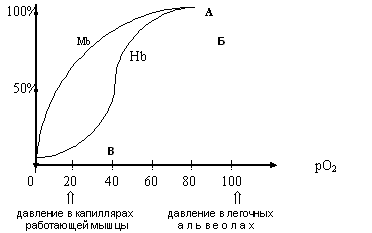




 О2 4О2
О2 4О2




 2НСО3 + 2Н+ 2Н++ 2НСО3-
2НСО3 + 2Н+ 2Н++ 2НСО3- 
 2CО2+2Н2О 2С2CО2 + 2Н2О
2CО2+2Н2О 2С2CО2 + 2Н2О
 СО2
СО2 НЬ• 2Н+
НЬ• 2Н+


 Р
Р