
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Закон гей люссака — при постоянном давлении объём постоянной массы газа пропорционален абсолютной температуреСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Закон Гей Люссака — при постоянном давлении объём постоянной массы газа пропорционален абсолютной температуре
Объем V данной массы газа при постоянном давлении газа прямо пропорционален изменению температуры
Закон Гей-Люссака справедлив только для идеальных газов, реальные газы подчиняются ему при температурах и давлениях, далеких от критических значений. Является частным случаем уравнения Клайперона.
7. Французский ученый Ж. Шарль в 1787 году нашел экспериментально зависимость давления газа от температуры при постоянном объеме. Данные лежат в основе газового закона Шарля. Формулировка закона Шарля следующая: для данной массы газа отношение давления газа к его температуре постоянно, если объем газа не меняется. Эту зависимость математически записывают так: P/Т=const, если V=const и m=const 8. АВОГА́ДРО ЗАКО́Н, один из основных законов идеальных газов: в равных объемах идеальных газов при одинаковых давлении и температуре содержится одинаковое число молекул. Число молекул в одном моле называют постоянной Авогадро или числом Авогадро. Закон был открыт А. Авогадро в 1811. Согласно закону Авогадро, 1 моль любого идеального газа при нормальных условиях занимает одинаковый объем. При давлении р =101,325 кПа и температуре Т = 273,15 К этот объем равен 22,41383 м3. Следовательно, моль любого вещества содержит одно и то же число молекул, равное числу Авогадро 6,022045(31).1023 моль-1. Из закона Авогадро следует, что при одних и тех же давлении и температуре плотности двух идеальных газов прямо пропорциональны, а удельные объемы обратно пропорциональны их молекулярным массам.
9. Воздух в комнате, где мы находимся, представляет собой смесь нескольких газов, в основном — азота (около 80%) и кислорода (около 20%). Парциальное давление каждого из этих газов — это давление, которое имел бы газ, если бы он один занимал весь объем. К примеру, если бы все газы, кроме азота, удалили из комнаты, то давление того, что осталось, и было бы парциальным давлением азота. Закон Дальтона утверждает, что общее давление всех газов вместе взятых равно сумме парциальных давлений каждого газа в отдельнсти. (Строго говоря, закон применим только кидеальным газам , но с достаточно хорошим приближением он описывает также и реальные газы.)Джон Дальтон сформулировал этот закон в 1801 году, хотя молекулярно-кинетическая теория газов (модель, описывающая поведение газов), из которой он непосредственно вытекает, была разработана позже — уже в середине XIX века. Давление газа на стенки сосуда представляет собой результат столкновения молекул газа с этими стенками. Рассматривая газ с этих позиций, нетрудно понять, что количество столкновений со стенкой молекул каждого вида будет зависеть от того, как много молекул этого вида присутствует в газе. А из этого следует, что общее давление, представляющее собой сумму столкновений всех молекул, получается при сложении числа столкновений молекул каждого вида.
10. Наиболее вероятная скорость молекул — это скорость, вблизи которой на единичный интервал скоростей приходится наибольшее число молекул
Цикл Карно
КПД цикла Карно:
Отсюда видно, что КПД цикла Карно с идеальным газом зависит только от температуры награвателя (Tн) и холодильника (Тх). Из уравнения следуют выводы: 1. Для повышения КПД тепловой машины нужно увеличить температуру нагревателя и уменьшить температуру холодильника; 2. КПД тепловой машины всегда меньше 1. Следствия Недостижимость абсолютного нуля температур 45. Критическая точка — сочетание значений температуры Критическая температура фазового перехода — значение температуры в критической точке. При температуре выше критической температуры газ невозможно сконденсировать ни при каком давлении. В критической точке плотность жидкости и её насыщенного пара становятся равны, а поверхностное натяжение жидкости падает до нуля, потому исчезает граница раздела фаз жидкость-пар. Для смеси веществ критическая температура не является постоянной величиной и может быть представлена пространственной кривой (зависящей от пропорции составляющих компонентов), крайними точками которой являются критические температуры чистых веществ — компонентов рассматриваемой смеси.
46.
47. В термодинамике Метастабильные состояния соответствуют одному из минимумов термодинамического потенциала системы при заданных внешних условиях. Устойчивому (стабильному) состоянию отвечает самый глубокий минимум. Однородная система в метастабильном состоянии удовлетворяет условиям устойчивости равновесия термодинамического В квантовых системах Метастабильные состояния в квантовых системах — состояние с временем жизни (
Закон Гей Люссака — при постоянном давлении объём постоянной массы газа пропорционален абсолютной температуре
Объем V данной массы газа при постоянном давлении газа прямо пропорционален изменению температуры
Закон Гей-Люссака справедлив только для идеальных газов, реальные газы подчиняются ему при температурах и давлениях, далеких от критических значений. Является частным случаем уравнения Клайперона.
7. Французский ученый Ж. Шарль в 1787 году нашел экспериментально зависимость давления газа от температуры при постоянном объеме. Данные лежат в основе газового закона Шарля. Формулировка закона Шарля следующая: для данной массы газа отношение давления газа к его температуре постоянно, если объем газа не меняется. Эту зависимость математически записывают так: P/Т=const, если V=const и m=const 8. АВОГА́ДРО ЗАКО́Н, один из основных законов идеальных газов: в равных объемах идеальных газов при одинаковых давлении и температуре содержится одинаковое число молекул. Число молекул в одном моле называют постоянной Авогадро или числом Авогадро. Закон был открыт А. Авогадро в 1811. Согласно закону Авогадро, 1 моль любого идеального газа при нормальных условиях занимает одинаковый объем. При давлении р =101,325 кПа и температуре Т = 273,15 К этот объем равен 22,41383 м3. Следовательно, моль любого вещества содержит одно и то же число молекул, равное числу Авогадро 6,022045(31).1023 моль-1. Из закона Авогадро следует, что при одних и тех же давлении и температуре плотности двух идеальных газов прямо пропорциональны, а удельные объемы обратно пропорциональны их молекулярным массам.
9. Воздух в комнате, где мы находимся, представляет собой смесь нескольких газов, в основном — азота (около 80%) и кислорода (около 20%). Парциальное давление каждого из этих газов — это давление, которое имел бы газ, если бы он один занимал весь объем. К примеру, если бы все газы, кроме азота, удалили из комнаты, то давление того, что осталось, и было бы парциальным давлением азота. Закон Дальтона утверждает, что общее давление всех газов вместе взятых равно сумме парциальных давлений каждого газа в отдельнсти. (Строго говоря, закон применим только кидеальным газам
Джон Дальтон сформулировал этот закон в 1801 году, хотя молекулярно-кинетическая теория газов (модель, описывающая поведение газов), из которой он непосредственно вытекает, была разработана позже — уже в середине XIX века. Давление газа на стенки сосуда представляет собой результат столкновения молекул газа с этими стенками. Рассматривая газ с этих позиций, нетрудно понять, что количество столкновений со стенкой молекул каждого вида будет зависеть от того, как много молекул этого вида присутствует в газе. А из этого следует, что общее давление, представляющее собой сумму столкновений всех молекул, получается при сложении числа столкновений молекул каждого вида. 10.
|
|||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 1596; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.91.116 (0.011 с.) |

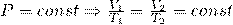

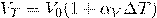
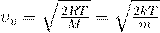

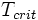 и давления
и давления  (или, что эквивалентно, молярного объёма
(или, что эквивалентно, молярного объёма  ), при которых исчезает различие в свойствах жидкой и газообразной фаз вещества.
), при которых исчезает различие в свойствах жидкой и газообразной фаз вещества. ,
,  , относительно малых возмущений физических параметров (энтропии, плотности и др.). При достаточно больших возмущениях система переходит в абсолютно устойчивое состояние. Большой класс метастабильных состояний связан с фазовыми переходами 1-го рода (кристалл
, относительно малых возмущений физических параметров (энтропии, плотности и др.). При достаточно больших возмущениях система переходит в абсолютно устойчивое состояние. Большой класс метастабильных состояний связан с фазовыми переходами 1-го рода (кристалл  жидкость
жидкость 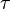 ), много большим характерного времени жизни возбуждённых состояний (
), много большим характерного времени жизни возбуждённых состояний ( с) атомной системы. Обычно метастабильными считают возбуждённые состояния, излучательные (радиационные), переходы из которых в другие состояния запрещены строгими правилами отбора. Метастабильные состояния отличаются типом переходов, которые для них возможны: магнитный дипольный, электрический квадрупольный, двухфотонный и другие переходы.
с) атомной системы. Обычно метастабильными считают возбуждённые состояния, излучательные (радиационные), переходы из которых в другие состояния запрещены строгими правилами отбора. Метастабильные состояния отличаются типом переходов, которые для них возможны: магнитный дипольный, электрический квадрупольный, двухфотонный и другие переходы.


