
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
I. Рабочее тело и параметры его состояния. Основные законы идеального газа.Содержание книги
Поиск на нашем сайте
Основы термодинамики
Термодинамика – наука, изучающая превращения энергии в различных процессах, сопровождающихся тепловыми эффектами. Методы термодинамики основаны на универсальном законе природы– законе сохранении энергии. I.Рабочее тело и параметры его состояния. Основные законы идеального газа. Газ Способность газа заполнять весь объем, в который его помещают, подтверждает, что молекулы газа находятся в постоянном движении. Установлено, что движение молекул газа беспорядочно и хаотично. Простой моделью реального газа является так называемый идеальный газ, у которого объем, занимаемый его молекулами, мал по сравнению с объемом всего рассматриваемого газа; молекулы газа рассматриваются как беспорядочно движущиеся материальные точки, распределенные равномерно во всем объеме газа. Силами сцепления между молекулами идеального газа пренебрегают. Следует помнить, что идеального газа в действительности нет; это модель, которая отражает свойства реальных газов приближенно. Тем не менее, изучение законов идеального газа помогает определять поведение реального газа в различных условиях. Чем ниже давление и выше температура, тем ближе свойства реального газа к свойствам идеального. В дальнейшем все выводы и зависимости будут относиться к идеальному газу. Рабочее тело и его параметры Часто тепловой процесс включает в себя теплообмен, когда есть источник тепла с температурой Т1 – нагреватель и охладитель с температурой Т2<T1 – холодильник. Хорошо известно,что превратить механическую работу в тепло очень просто – для этого необходимо создать поверхность трения; в частности древние люди добывали так огонь. Значительно труднее преобразовать тепло в механическую работу (энергию). Если нагреватель и холодильник привести в непосредственное соприкосновение, то тепло от первого перейдет ко второму и при этом никакой работы совершено не будет. Произойдет простой теплообмен. Пример. Если привести в соприкосновение два куска железа – нагретый и холодный, то от горячего куска тепло будет переходить к холодному до тех пор,пока их температура не сравняется. Для получения механической работы (энергии) в любом тепловом двигателе необходимо привлечь еще одно тело, которое называется рабочим телом. Пример. В двигателе внутреннего сгорания рабочим телом является газ, образующийся в процессе сгорания рабочей смеси, в паровых турбинах – водяной пар. Нагревателем являются продукты сгорания топлива, а холодильником – атмосфера, куда выбрасывается отработавший газ или конденсатор, принимающий отработавший водяной пар. В зависимости от рассматриваемой задачи при термодинамическом исследовании выделяется определенная группа тел, которая называется термодинамической системой. Тела, взаимодействующие с системой и оказывающие влияние на ее свойства, называются внешней средой. Например, цилиндр, поршень, окружающий воздух и т.д. Термодинамическим процессом называют изменение состояния термодинамической системы в результате обмена энергией (тепловой или механической) с окружающей средой. Физические величины, характеризующие термодинамическое состояние системы, называются параметрами состояния. Важнейшими из них являются удельный объем υ, давление p и температура T. Следует иметь в виду, что в любой термодинамической системе никогда не изменяется один параметр - обязательно изменяются минимум два их них одновременно. Давление. В термодинамике всегда пользуются абсолютным давлением, т.е. атмосферное плюс избыточное. Свойство газа оказывать давление на стенки сосуда, в котором он находится, есть одно из его основных свойств. Именно оно позволяет использовать газ в качестве рабочего тела в процессах преобразования энергии. Жидкости или твердые тела почти не используются в качестве рабочих тел. Температура. Величину, характеризующую степень нагретости тела, называют температурой. Температуру газа рассматривают как меру средней кинетической энергии молекул газа. С этой точки зрения температура должна измеряться в единицах энергии, но в технике это неудобно. По этой причине температуру измеряют в градусах (коэффициентом перевода является постоянная Больцмана k, Дж/град). В термодинамических расчетах пользуются шкалой, предложенной в 1848г. английским ученым Кельвином. Нулем шкалы Кельвина является температура, при которой прекращаются хаотические движения молекул идеального газа; эту температуру называют абсолютным нулем. Абсолютный нуль соответствует температуре -273,15о по шкале Цельсия. Температура, отсчитывается по шкале Кельвина всегда положительно. Ее называют абсолютной температурой и обозначают ToK. В технике очень часто пользуются шкалой Цельсия; температуру по этой шкале отсчитывают от точки замерзания воды, принимая температуру в этой точке равной нулю. Температуру по этой шкале обозначают toC. Связь между температурой по абсолютной шкале и температурой по Цельсию определяется по формуле ToK= 273,15+toC Теплоемкость Чтобы два разных вещества с одинаковой массой нагреть до одинаковой температуры, необходимо затратить различное количество теплоты. Например, на нагревание воды необходимо затратить тепла примерно в девять раз больше, чем на нагревание до той же температуры такой же массы железа. Таким образом, каждое вещество обладает своей теплоемкостью. Теплоемкостью тела называют количество теплоты,необходимое для изменения температуры тела на один градус. Средней в интервале температур T1 – T2 теплоемкостью тела Сm называют количество теплоты q, необходимое для повышения температуры тела на 1o
При уменьшении разности температур Т2 – Т1 средняя теплоемкость приближается к истинной. Если к телу подведено бесконечно малое количество теплоты dq и температура тела Т повысилась на величину dT, то отношение
называется истинной теплоемкостью тела при температуре Т. Удельная теплоемкость Для определения теплоемкости разных веществ, для возможности сравнения их между собой введено понятие удельной теплоемкости. Удельной теплоемкостью называют количество теплоты, необходимо для изменения температуры единицы количества вещества на один градус.
Удельная массовая теплоемкость
Первый закон термодинамики Основные определения Состояние системы. Неравновесное состояние системы характеризуется различными значениями ее параметров в каждой точке системы. Равновесным считают такое состояние системы, при котором во всех ее точках параметры системы имеют одинаковые неизменные во времени значения. Если все точки системы имеют одинаковую температуру, то считается, что система находится в состоянии термического равновесия. Если давление одинаково во всех точках системы,то она находится в состоянии механического равновесия. Опыт показывает, что система, выведенная из равновесия и не подвергающаяся больше внешним воздействиям, самостоятельно вернется в равновесное состояние. Из равновесного состояния в неравновесное система не может перейти без внешнего воздействия. Если рабочее тело под воздействием внешних или внутренних факторов выведено из равновесия, то все параметры,характеризующие его состояние, изменяются, т.е. начнется термодинамический процесс изменения состояния рабочего тела. Термодинамический процесс может быть наглядно представлен в виде графика на pV – диаграмме:
Рис 1. Допустим, что в рабочем пространстве цилиндра 1, снабженного поршнем 2 заключена масса газа m с начальными параметрами p1 и υ1 (точка 1). Примем, что на поршень с внешней стороны действует постоянная сила P и газ находится в состоянии равновесия. Для осуществления процесса необходимо нарушить равновесие системы. Процесс, переводящий тело из одного состояния в другое, из точки 1 в точку 2, выразится некоторой кривой 1 -2 средних значений параметров. Точки1 и 2 точно характеризуют равновесное состояние газа в начале и в конце процесса. Вид кривой зависит от характера процесса. Такую кривую называют кривой термодинамического процесса. Внутренняя энергия системы. Кинетическую энергию микроскопических тепловых движений молекул и потенциальную энергию их взаимодействия называют внутренней энергией тела. В любом состоянии система, изолированная от внешней среды или находящаяся во взаимодействии с ней, имеет определенное количество внутренней энергии U. Если состояние системы изменилось в результате любого термодинамического процесса, то изменение ее внутренней энергии не зависит от того, как протекал этот процесс, а зависит только от конечного и начального состояния рабочего тела. Поэтому такое изменение внутренней энергии тела в процессе определяется разностью значений энергии в начале и конце взаимодействия тела с внешней средой
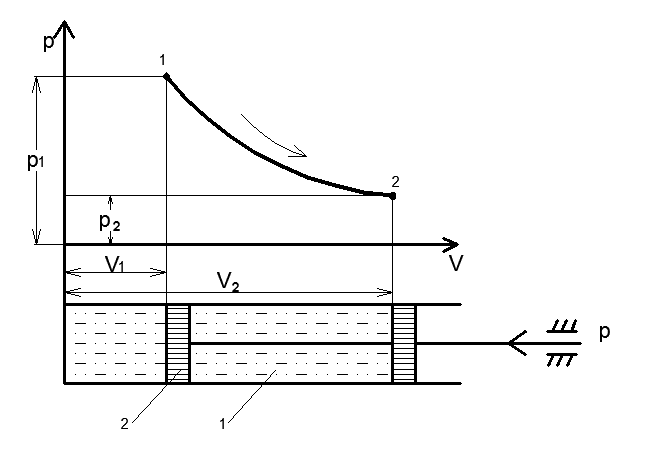
Где U1 и U2 – внутренняя энергии в начале и в конце процесса. Работа и количество теплоты. Механическая работа, рассматриваемая в термодинамике, является мерой механической энергии. Она производится при перемещении тела в пространстве под действием механической силы. Если газ, находящийся в цилиндре под поршнем, расширяется, то его объем увеличивается (d совершая механическую работу. Такую работу считают положительной. При сжатии газа (d Для того чтобы вычислить механическую работу, совершаемую термодинамической системой, рассмотрим систему, представляющую собой т кг газа, находящегося в цилиндре, под поршнем (при р = const). Его состояние определяется параметрами р1, V1, Т1, что на диаграмме (рис.1) соответствует точке 1. Давление, газа p1 уравновешено внешней силой Р, приложенной к штоку поршня. Таким образом, система находится в равновесии. Подведем к системе теплоту Q, которая нарушит равновесное состояние газа. Газ под действием теплоты, расширяясь, будет давить на поршень с силой R, преодолевая силу Р, и передвинет его вправо на расстояние х, совершив при этом работу. Состояние газа в точке определится параметрами р2, V2 и T 2. Совершенную газом работу можно вычислить по общим правилам механики, а можно также определить графически, изобразив ее на pV-диаграмме.
Как известно из механики, работа равна произведению силы на путь. В нашем случае работа L, совершенная газом под действием сил R, равна произведению этой силы на путь х: Сила R, с которой газ передвигает поршень слева направо, равна произведению давления газа р на площадь поршня F:
где
Подставив в формулу (18) значение R из формулы (19), получим
Но произведение площади F поршня на путь x представляет собой объем цилиндра между начальным и конечным положениями поршня:
Подставив в формулу (20) значение объема цилиндра
или
Из формулы видно, что изменение объема газа сопровождается работой, равной произведению давления, под которым находится газ, на изменение его объема. Теперь по конечным параметрам газа построим график на pV- диаграмме, определяющий зависимость между его объемом в цилиндре и абсолютным давлением. Диаграмма дает возможность графически оценить работу расширения газа.(рис.2)
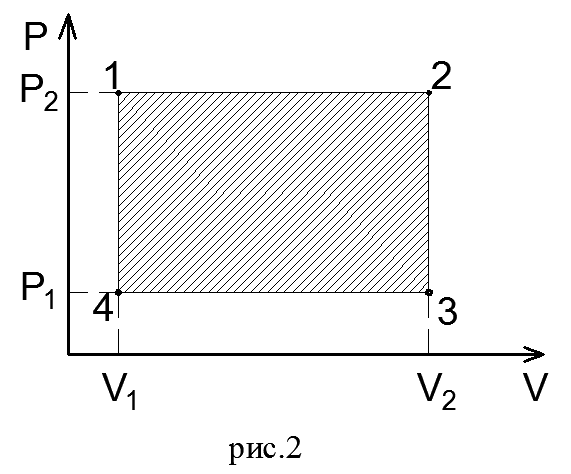
Так как давление газа в процессе расширения принято постоянным, то линия процесса 1-2 на диаграмме параллельна оси абсцисс. Поэтому, опустив перпендикуляры из точек 1 и 2, начала и конца процесса, получим замкнутый контур в виде прямоугольника 12 3 4, образованный линией процесса 1-2, крайними ординатами 1,4 и 2,3 и отрезком оси абсцисс, равным V2— V1. Площадь диаграммы, расположенная в этом контуре, на рV-диаграмме определяет работу расширения газа. Ее легко определить умножением ее основания на высоту. В термодинамическом процессе, где давление меняется с изменением объема (рис.3), количество работы также определяется пл.1 2 3 4, ограниченной линией процесса 1-2, осью абсцисс 4,3 и крайними ординатами 2,3 и 1,4. Однако замкнутый контур 1234 является сложной фигурой. Эту работу можно вычислить аналитически. Для этого разобьем весь процесс, изображенный на диаграмме кривой 1-2, на большое число бесконечно малых процессов и определим работу расширения газа одного такого элементарного процесса. В бесконечно малом изменении состояния газа изменение его параметров также бесконечно мало. Поэтому можно считать, что в пределах каждого элементарного процесса давление газа остается постоянным. Тогда по формуле (23) элементарная работа dL расширения газа при изменении объема на величину
На рV-диаграмме элементарная работа dL изобразится в виде площади бесконечно узкого прямоугольника абвг (рис.3), величина которого определится произведением его основания на высоту р. Очевидно, кривая всего процесса 1-2 представится в виде ступенчатой кривой, составленной из элементарных процессов. Можно себе представить, что при бесконечном увеличении числа элементарных участков ступенчатая кривая превратится в плавную кривую процесса. Полная работа расширения т кг газа в процессе 1-2 определится суммой элементарных работ. Эта сумма равна определенному интегралу, взятому в пределах от начального объема V1 до конечного объема V2:
Отнеся работу расширения к 1 кг массы газа, получим
или
Количество теплоты в термодинамическом процессе является мерой тепловой энергии, подведенной к системе или отведенной от системы. Не следует говорить о количестве теплоты, содержащейся в теле, а можно говорить лишь о том, сколько тело отдаст или получит теплоты в том или ином процессе. В отличие от внутренней энергии работа и количество теплоты зависят не только от начального и конечного состояния газа, но и от пути, по которому происходило изменение его состояния. Количество теплоты, полученное телом, принято считать положительным, а отданное телом — отрицательным. Количества теплоты и работы измеряются в одних и тех же единицах— в джоулях (дж). Закон сохранения энергии устанавливает, что энергия не создается, не уничтожается и что одна форма энергии может переходить в другую; при этом превращение совершается таким образом, что определенное количество одной формы энергии переходит в равное количество другой формы энергии. Первый закон термодинамики по существу является законом сохранения энергии. Он устанавливает количественную зависимость между подводимой к системе теплотой, ее внутренней энергией и совершаемой системой работой (механической энергией). Первый закон (начало) термодинамики формулируют так: вся теплота, подведенная к системе, расходуется на изменение внутренней энергии системы и на совершение внешней работы:
где Q — подведенная к системе теплота; U1— внутренняя энергия системы в начале процесса; U2— внутренняя энергия системы в конце процесса; L — работа, совершенная системой. Если первый закон выразить в дифференциальной форме и работу, совершенную газом, отнести к 1 кг газа, то уравнение (28) примет вид
Первый закон термодинамики, устанавливая количественную зависимость между видами энергии, не указывает условий, при которых протекают преобразования одного вида энергии в другой. Сравнивая равенства (26) и (29), можно первый закон термодинамики представить в виде
Следствие первого закона термодинамики Применяя первый закон термодинамики возможно доказать, что теплоемкости одного и того же газа в процессах при постоянном давлении Cp и при постоянном объеме Cv различны по своей величине, а именно
где R- газовая постоянная. Для удобства термодинамических расчетов вводится новый параметр состояния рабочего тела—энтропия. Рассмотрим уравнение первого закона термодинамики:
Разделив обе части этого уравнения на Т, получим
А так как из уравнения Клапейрона pv = RT следует, что
то подставив в равенство (32) значение р/Т из равенства (33), получим
Правая часть этого уравнения представляет собой полный дифференциал некоторой функции переменных Т и V. Обозначив эту функцию через s, запишем
Другими словами, величина Уравнение (35) дает приращение энтропии при бесконечно малом изменении состояния газа. Проинтегрировав это уравнение, получим изменение энтропии для конечного изменения состояния 1 кг газа:
Энтропия так же, как и удельная теплоемкость, измеряется в
Действительно, если линия 1-2 на Ts-диаграмме (рис.4) изображает произвольный процесс, то элементарное количество теплота процесса dq, равное Tds, численно равно площадке, имеющей высоту Т и основание ds. Вся теплота процесса численно равна пл. 12 3 4 под кривой процесса, так как
Если рυ-диаграмма дает возможность графически определить величину полученной (или затраченной) работы, то Тs - диаграмма позволяет судить о степени использования теплоты. Рассмотрим уравнение (30) первого закона термодинамики:
Напишем это уравнение для произвольного конечного процесса изменения состояния газа, определяемого участком любой кривой 1-2:
Так как
то уравнение (30) можно переписать:
или
В первом члене правой части этого уравнения под знаком дифференциала стоит величина u + p
Энтальпия является одной из самых важных функций технической термодинамики. Подставляя в уравнение первого закона термодинамики величину, найденную из уравнения (43), получим следующее выражение для первого закона термодинамики:
где Для процесса при р = const (
Отсюда следует, что количество теплоты, которое передается в процессе с постоянным давлением, можно найти как разность энтальпий в конечном и начальном состояниях процесса р = const. При этом удобно использовать имеющиеся таблицы или диаграммы газов. Плоская многослойная стенка В практике большое значение имеет процесс передачи теплоты через плоскую стенку, состоящую из нескольких слоев материала с различной теплопроводностью. Так, например, металлическая стенка парового котла, покрытая с внешней стороны шлаками, а с внутренней накипью, представляет собой трехслойную стенку.
Процесс передачи теплоты теплопроводностью через многослойную стенку рассматривается при стационарном режиме, поэтому удельный тепловой поток q, проходящий через каждый слой стенки, по величине постоянен и для всех слоев одинаков, но на своем пути он преодолевает местное термическое сопротивление δ/λ каждого слоя стенки. Поэтому на основании формулы (54) для каждого слоя можно написать:
Из этих равенств можно определить изменение температуры в каждом слое:
Складывая левые и правые части равенств (58), получим полный температурный напор, состоящий из суммы изменений температуры в каждом слое:
Из последнего соотношения можно определить величину удельного теплового потока q, проходящего через многослойную стенку:
Из уравнения (59) следует, что общее термическое сопротивление многослойной стенки равно сумме термических сопротивлений каждого слоя:
Для n-слойной стенки формула (13) примет вид
По формулам (58) и (59) можно получить значения неизвестных температур t2 и t3:
или
Распределение температуры в каждом слое стенки при λ-const подчиняется линейному закону, что видно из равенства (58). Для многослойной стенки в целом температурная кривая представляет собой ломаную линию (на рис.7). Формулами, полученными для многослойной стенки, можно пользоваться при условии хорошего теплового контакта между слоями. Если между слоями появится хотя бы небольшой воздушный зазор, то термическое сопротивление заметно увеличится, так как теплопроводность воздуха очень мала: [λВ03Д = 0,023 вт/(м Если наличие такого слоя неизбежно, то при расчетах он рассматривается как один из слоев многослойной стенки. Конвективный теплообмен. Конвективный теплообмен представляет собой теплообмен между твердым телом и жидкостью (или газом), сопровождающийся одновременно теплопроводностью и конвекцией. Явление теплопроводности в жидкости, как и в твердом теле, полностью определяется свойствами самой жидкости, в частности коэффициентом теплопроводности и градиентом температуры. При конвекции перенос теплоты неразрывно связан с переносом жидкости. Это усложняет процесс, так как перенос жидкости зависит от характера и природы возникновения ее движения, физических свойств жидкости, формы и размеров поверхностей твердого тела и т. д. Рассмотрим случай протекания около твердой стенки жидкости, температура которой ниже (или выше) температуры стенки. Между жидкостью и стенкой происходит теплообмен. Переход теплоты от стенки к жидкости (или обратно) назовем теплоотдачей. Ньютон показал, что количество теплоты Q, которым обмениваются между собой в единицу времени стенка, имеющая температуру Тст , и жидкость, имеющая температуру Тж, прямо пропорционально разности температур Тст — Тж и площади поверхности соприкосновения S: Q = αS (Тст — Тж) (60) где α — коэффициент теплоотдачи, который показывает, каким количеством теплоты в течение одной секунды обмениваются жидкость и стенка, если разность температур между ними 1 К, а площадь поверхности, омываемой жидкостью, равна 1 м2. В СИ единицей коэффициента теплоотдачи является Вт/(м2 Турбулентному и ламинарному движению жидкости соответствует различный характер передачи теплоты. При ламинарном движении теплота распространяется в направлении, перпендикулярном перемещению частиц жидкости, так же как и в твердом теле, т. е. теплопроводностью. Так как коэффициент теплопроводности жидкости невелик, то распространяется теплота при ламинарном течении в направлении, перпендикулярном потоку, очень слабо. При турбулентном движении слои жидкости (более и менее нагретые) перемешиваются, и теплообмен между жидкостью и стенкой в данных условиях идет более интенсивно, чем при ламинарном течении. В пограничном слое жидкости (у стенок трубы) теплота передается только теплопроводностью. Поэтому пограничный слой представляет собой большое сопротивление потоку теплоты, и в нем происходит наибольшая потеря температурного напора. Помимо характера движения, коэффициент теплоотдачи зависит от свойств жидкости и твердого тела, температуры жидкости и т. д. Таким образом, теоретически определить коэффициент теплоотдачи довольно сложно. На основании большого экспериментального материала найдены следующие значения коэффициентов теплоотдачи [в Вт/(м2
В основном конвективный теплообмен происходит при продольном вынужденном течении жидкости, например теплообмен между стенками трубы и жидкостью, текущей по ней; поперечном вынужденном обтекании, например теплообмен при омывании жидкостью поперечного пучка труб; свободном движении, например теплообмен между жидкостью и вертикальной поверхностью, которую она омывает; изменении агрегатного состояния, например теплообмен между поверхностью и жидкостью, в результате которого жидкость закипает или происходит конденсация ее паров. Лучистый теплообмен. Лучистым теплообменом называют процесс передачи теплоты от одного тела к другому в форме лучистой энергии. В теплотехнике в условиях высоких температур теплообмен излучением имеет первостепенное значение. Поэтому современные теплотехнические агрегаты, рассчитанные на высокие температуры, максимально используют этот вид теплообмена.
В результате поглощения и излучения телами лучистой энергии происходит теплообмен между ними. Количество теплоты, поглощаемое телом в результате лучистого теплообмена, равно разности между энергией, падающей на него, и излучаемой им. Такая разность отлична от нуля, если температура тел, участвующих во взаимном обмене лучистой энергией, различна. Если температура тел одинакова, то вся система находится в подвижном тепловом равновесии. Но и в этом случае тела по-прежнему излучают и поглощают лучистую энергию. Энергию, излучаемую единицей поверхности тела в единицу времени, называют его излучательной способностью. Единица излучательной способности Вт/ма. Если на тело в единицу времени падает Q0 энергии (рис.8), QR отражается, QD проходит через него, QA поглощается им, то
где QA/Q0 = A — поглощательная способность тела; QR/Qo = R — отражательная способность тела; QD/Q0 = D — пропускающая способность тела. Если А = 1, то R = D = 0, т. е. вся падающая энергия полностью поглощается. В этом случае говорят, что тело является абсолютно черным. Если R = 1,тоA=D = 0и угол падения лучей равен углу отражения. В этом случае тело абсолютно зеркально, а если отражение рассеянное (равномерное по всем направлениям) — абсолютно белое. Если D = 1,to A=R= 0 и тело абсолютно прозрачное. В природе нет ни абсолютно черных, ни абсолютно белых, ни абсолютно прозрачных тел. Реальные тела могут лишь в какой-то мере приблизиться к одному из таких видов тел. Поглощательная способность различных тел различна; более того, одно и то же тело по-разному поглощает энергию различных длин волн. Однако есть тела, для которых в определенном интервале длин волн поглощательная способность мало зависит от длины волны. Такие тела принято называть серыми для данного интервала длин волн. Практика показывает, что применительно к интервалу длин волн, используемых в теплотехнике, очень многие тела можно считать серыми. Энергия, излучаемая единицей поверхности абсолютно черного тела в единицу времени, пропорциональна четвертой степени абсолютной температуры (закон Стефана—Больцмана):
Е0 =σ'0ТА, где σ'0 — константа излучения абсолютно черного тела:
σ'0= 5,67-10-8 Вт/(м2- К4). Часто этот закон записывают в виде
где Многие законы излучения, установленные для абсолютно черного тела, имеют огромное значение для теплотехники. Так, полость топки котельной установки можно рассматривать как модель абсолютно черного тела (рис. 9). Применительно к такой модели законы излучения абсолютно черного тела выполняются с большой точностью. Однако пользоваться этими законами применительно к тепловым установкам следует осторожно. Например, для серого тела закон Стефана—Больцмана имеет вид, аналогичный формул
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 456; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.105.46 (0.011 с.) |




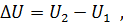
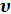 >0). При этом газ передвигает поршень,
>0). При этом газ передвигает поршень,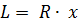
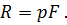
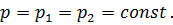
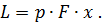
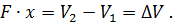
 , получим величину работы, совершенной газом при его расширении:
, получим величину работы, совершенной газом при его расширении: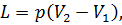
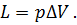
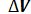 = dV равна
= dV равна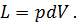
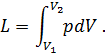
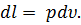
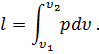
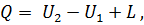
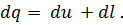
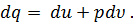
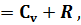
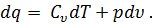
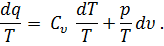
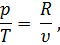
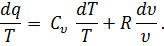
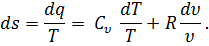
 есть полный дифференциал ds функции s, определяемый состоянием газа (температурой и удельным объемом). Эту величину называют энтропией.
есть полный дифференциал ds функции s, определяемый состоянием газа (температурой и удельным объемом). Эту величину называют энтропией.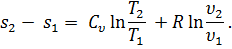
 Отсутствие приборов для измерения энтропии долгое время задерживало ее применение в решении технических задач. Простота и удобство применения энтропия в качестве параметра привели к широкому использованию ее в теплотехнических расчетах.
Отсутствие приборов для измерения энтропии долгое время задерживало ее применение в решении технических задач. Простота и удобство применения энтропия в качестве параметра привели к широкому использованию ее в теплотехнических расчетах.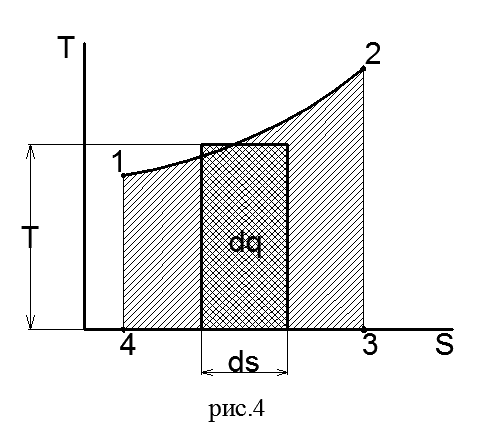 Одним из важных вопросов теплотехники является подсчет теплоты, подведенной к двигателю и отведенной от него. По степени использования теплоты судят о работе двигателя и о его экономичности. Этот вопрос легко разрешается графическим изображением термодинамического процесса в системе координат, где по оси абсцисс откладывают значения энтропии, а по оси ординат - значения температуры. Так же, как и на pυ-диаграмме, состояния тела в каждый момент времени на Ts-диаграмме изображается точкой, процесс — линией. Теплота процесса на Ts-диаграмме определяется площадью под линией процесса.
Одним из важных вопросов теплотехники является подсчет теплоты, подведенной к двигателю и отведенной от него. По степени использования теплоты судят о работе двигателя и о его экономичности. Этот вопрос легко разрешается графическим изображением термодинамического процесса в системе координат, где по оси абсцисс откладывают значения энтропии, а по оси ординат - значения температуры. Так же, как и на pυ-диаграмме, состояния тела в каждый момент времени на Ts-диаграмме изображается точкой, процесс — линией. Теплота процесса на Ts-диаграмме определяется площадью под линией процесса.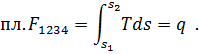
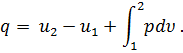
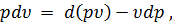
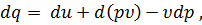
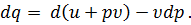
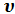 при постоянном давлении р. Величину u + p
при постоянном давлении р. Величину u + p 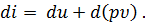
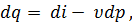

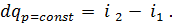
 Рассмотрим процесс передачи теплоты теплопроводностью через плоскую-трехслойную стенку (рис.7). Все слои такой стенки плотно прилегают друг к другу. Толщины слоев обозначены δ1, δ2 и δ3, а коэффициенты теплопроводности каждого материала λ1, λ2 и λ3 соответственно. Известны также температуры наружных поверхностей tl и t4. Температуры t2 и t3 неизвестны.
Рассмотрим процесс передачи теплоты теплопроводностью через плоскую-трехслойную стенку (рис.7). Все слои такой стенки плотно прилегают друг к другу. Толщины слоев обозначены δ1, δ2 и δ3, а коэффициенты теплопроводности каждого материала λ1, λ2 и λ3 соответственно. Известны также температуры наружных поверхностей tl и t4. Температуры t2 и t3 неизвестны.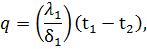








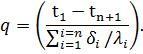

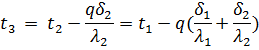
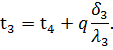
 град)].
град)]. Любое тело, температура которого отлична от абсолютного нуля, излучает электромагнитные волны. Их энергию способно поглотить, отразить, а также пропустить через себя какое-либо другое тело. В свою очередь, это тело также излучает энергию, которая вместе с отраженной и пропущенной энергией попадает на окружающие тела (в том числе и на первое тело) и вновь поглощается, отражается ими и т. д. Из всех электромагнитных лучей наибольшим тепловым действием обладают инфракрасные и видимые лучи с длиной волны 0,4—40 мкм. Эти лучи называют тепловыми.
Любое тело, температура которого отлична от абсолютного нуля, излучает электромагнитные волны. Их энергию способно поглотить, отразить, а также пропустить через себя какое-либо другое тело. В свою очередь, это тело также излучает энергию, которая вместе с отраженной и пропущенной энергией попадает на окружающие тела (в том числе и на первое тело) и вновь поглощается, отражается ими и т. д. Из всех электромагнитных лучей наибольшим тепловым действием обладают инфракрасные и видимые лучи с длиной волны 0,4—40 мкм. Эти лучи называют тепловыми.


 — коэффициент излучения абсолютно черного тела;
— коэффициент излучения абсолютно черного тела;  К4).
К4).


