
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Уравнение для радиальной части волновой функцииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Введя постоянную l, запишем уравнение для радиальной части
Это уравнение зависит от потенциала U(r). Поэтому, чтобы решать данное уравнение необходимо знать конкретный вид центрального потенциала. Для атома водорода Введем атомную систему единиц, где: · единицей длины является · единицей энергии - · скорости Чтобы перейти к этой системе единиц надо во всех формулах положить
Тогда
Это уравнение можно также записывать в виде
Величина, заключенная в скобки, называется эффективным потенциалом
Будем решать уравнение Шредингера для случая, когда энергия собственных состояний отрицательна (E<0) и введем параметр
Тогда
Найдем асимптотику функции
В пределе
Решение ищем в виде ряда
После подстановки этого ряда в (5.12)
Таким образом,
Полином
В последней формуле мы ввели новое целое квантовое число
где Рассмотрим состояния с используя известный интеграл
В этих состояниях
Энергии стационарных состояний водородоподобного атома определяются только главным квантовым числом n (для водорода Z=1)
В естественных единицах В общем случае решение радиального уравнения Шредингера для атомов выполняется численно, что связано с необходимостью учета внутриатомных эффектов взаимодействия между электронами.
Уравнение для угловой части Угловая часть волновой функции находится из уравнения
Записывая явный вид оператора Лежандра, имеем
Перепишем (5.19) в виде
Уравнение для угловой части не зависит от конкретного вида потенциала U (r) и для всех центральных полей имеет одно и то же решение. Это уравнение также можно разделить, если подставить в (5.20)
Действуя, как и ранее, получаем
Это уравнение называется присоединенным уравнением Лежандра. Из математики известно, что его решения имеют вид
Функции
Полиномы Лежандра определяются формулой Родригеса
Приведем значения некоторых из присоединенных полиномов Лежандра:
Соответствующие сферические гармоники
Теперь мы можем записать полное решение уравнения Шредингера для атома водорода (в атомной системе единиц)
Уровень
т.е. каждому
|
||||
|
Последнее изменение этой страницы: 2016-08-15; просмотров: 1352; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.34.211 (0.007 с.) |

 (5.8)
(5.8) Естественная система единиц включает в себя фундаментальные постоянные
Естественная система единиц включает в себя фундаментальные постоянные  .
. (боровский радиус),
(боровский радиус), ,
, где
где  - постоянная тонкой структуры.
- постоянная тонкой структуры. .
. (5.9)
(5.9)
 Благодаря второму слагаемому возникает центробежный барьер, не позволяющий электрону “упасть” на ядро. После замены
Благодаря второму слагаемому возникает центробежный барьер, не позволяющий электрону “упасть” на ядро. После замены  , получаем для радиальной функции c уравнение, не содержащее первой производной:
, получаем для радиальной функции c уравнение, не содержащее первой производной:
 (5.10)
(5.10)
 (5.11)
(5.11) при
при  . Для этого в (5.11) следует пренебречь вторым и третьим членами уравнения, в результате чего получаем уравнение
. Для этого в (5.11) следует пренебречь вторым и третьим членами уравнения, в результате чего получаем уравнение  , решением которого будет функция
, решением которого будет функция 
 надо рассмотреть
надо рассмотреть  Этому уравнению удовлетворяет функция
Этому уравнению удовлетворяет функция  . Из условия
. Из условия  следует, что
следует, что  или
или  . При отрицательном значении k
. При отрицательном значении k  , а
, а  Для функции
Для функции  имеем
имеем (5.12)
(5.12) (5.13)
(5.13) получаем рекуррентное соотношение
получаем рекуррентное соотношение 2
2  (5.14)
(5.14) и, если ряд не оборвать, он сходится к функции
и, если ряд не оборвать, он сходится к функции  . В этом случае функция
. В этом случае функция  также стремится к бесконечности, хотя из физических соображений она должна стремиться к нулю. Чтобы обеспечить правильное поведение волновой функции в этом пределе ряд (5.14) надо оборвать на некотором s = nr. Тогда
также стремится к бесконечности, хотя из физических соображений она должна стремиться к нулю. Чтобы обеспечить правильное поведение волновой функции в этом пределе ряд (5.14) надо оборвать на некотором s = nr. Тогда (5.15)
(5.15) при подходящем выборе
при подходящем выборе  называется полиномом Лагерра -
называется полиномом Лагерра -  ). Собственные значения энергии в атоме водорода определяются соотношением
). Собственные значения энергии в атоме водорода определяются соотношением (5.16)
(5.16) которое может принимать целые положительные значения
которое может принимать целые положительные значения  Это число, от которого зависят уровни энергии, получило название главного квантового числа. Окончательное решение радиального уравнения Шредингера для атома водорода имеет вид:
Это число, от которого зависят уровни энергии, получило название главного квантового числа. Окончательное решение радиального уравнения Шредингера для атома водорода имеет вид: , (5.17)
, (5.17) .
. , для которых
, для которых  а
а  ,
, . Таким образом, получим
. Таким образом, получим
 В основном состоянии (n=1)
В основном состоянии (n=1) 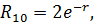
 Зная
Зная  и
и  . Для значений n = 1, 2 и 3 радиальные функции атома водорода имеют вид:
. Для значений n = 1, 2 и 3 радиальные функции атома водорода имеют вид:

 .
.
 (5.18)
(5.18) . (5.19)
. (5.19) (5.20)
(5.20) , где
, где  .
. . (5.21)
. (5.21) (5.22)
(5.22) называются присоединенными полиномами Лежандра. Они cвязаны с полиномами Лежандра
называются присоединенными полиномами Лежандра. Они cвязаны с полиномами Лежандра  соотношением
соотношением (5.23)
(5.23) (5.24)
(5.24)
 , которые нормированы и ортогональны по индексам l и m, имеют вид:
, которые нормированы и ортогональны по индексам l и m, имеют вид:


 (5.25)
(5.25) нормировка радиальной функции учитывается в коэффициентах
нормировка радиальной функции учитывается в коэффициентах  заменить на
заменить на  .
. вырожден по числам
вырожден по числам  т.к. при заданном главном квантовом числе n орбитальное число
т.к. при заданном главном квантовом числе n орбитальное число  пробегает значения от нуля до n-1, а
пробегает значения от нуля до n-1, а  Кратность вырождения равна
Кратность вырождения равна (5.26)
(5.26) волновых функций.
волновых функций.


