
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Уравнения 1 закона термодинамики для неподвижных телСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ Термодинамика, как самостоятельная наука, возникла в начале 19 века в связи с необходимостью теоретического обоснования тепловых процессов в паровых поршневых машинах. Основным содержанием термодинамики было изучение процессов взаимного превращения теплоты и механической работы, как двух форм обмена энергией. Техническая термодинамика (ТТД) изучает взаимное превращение тепловой и механической энергий с точки зрения применения этих превращений в технике, устанавливает пути достижения наибольшей полезной работы в различных тепловых двигателях и ТЭУ. Главным образом, ТТД исследует соотношения между параметрами термодинамических систем и совершаемой работой. ПАРАМЕТРЫ СОСТОЯНИЯ Параметры состояния – это характеристики состояния вещества, определяющие конкретные физические условия и однозначно определяющие состояние рассматриваемого вещества. Параметры состояния бывают интенсивные и экстенсивные. Интенсивные – параметры, не зависящие от количества вещества (давление, температура). Экстенсивные – параметры, зависящие от количества вещества (объем, внутренняя энергия, энтропия и др.). Все экстенсивные параметры обладают свойством аддитивности (суммироваться). Экстенсивные параметры приобретают свойства интенсивных, если их значения отнесены к единице количества вещества (удельные величины, отнесенные к 1 кг вещества; объемные величины, отнесенные к 1 м3 вещества; молярные величины, отнесенные к 1 кмоль вещества). Параметры, отражающие внутреннюю тепловую энергию, называют калорическими (внутренняя энергия, энтальпия, энтропия). Температура, давление и удельный объем являются основными параметрами состояния. Их также называют термическими параметрами состояния. ТЕРМОДИНАМИЧЕСКАЯ СИСТЕМА Термодинамической системой называется совокупность материальных тел, находящихся в тепловом и механическом взаимодействии. В ТТД материальные тела, входящие в состав системы, по их роли делят на горячие и холодные источники тепла (или теплоотдатчики и теплоприемники) и рабочие тела. ТЕРМОДИНАМИЧЕСКИЙ ПРОЦЕСС Термодинамическим процессом называется всякое изменение состояние тела или системы, связанное с тепловыми явлениями. Все процессы в термодинамической системе делятся на равновесные и неравновесные. ТЕПЛОТА И РАБОТА Изменение состояния термодинамической системы всегда связано с обменом энергией с окружающими ее телами. В рассматриваемых термодинамических процессах передача энергии происходит только в двух возможных формах – в форме теплоты и в форме работы. Количество энергии, переданной в форме хаотического (теплового) движения частиц, называют количеством тепла Q, или теплотой. Количество работы L, или также работой называют количество превращенной энергии из одного вида в другой. ТЕПЛОЕМКОСТЬ Теплоемкостью тела называется количество тепла, необходимое для нагрева тела на один градус, в данном процессе С = dQ / dТ, [Дж/К] где dQ – количество тепла, подведенное в каком-либо процессе. ВИДЫ ЭНЕРГИЙ Почти все виды энергии, рассматриваемые в ТТД, за исключением тепловой представляют собой энергию направленного движения. Механическая энергия – движение тел в пространстве. Электрическая энергия – движение электронов по проводнику. Химическая энергия – потенциальная энергия атомов, выделяющаяся при образовании новых молекул. Атомная (внутриядерная) энергия – потенциальная энергия, выделяющаяся при делении ядер атома или при синтезе. Свойством, присущим всем видам энергий, является способность каждого вида энергии переходить при определенных условиях в любой другой ее вид в строго определенном соотношении. Единица измерения – 1 Дж = 1 Н∙м = 1 кг∙м2/с2. Каждое тело в любом его состоянии может обладать одновременно различными видами энергии. При течении газа (или жидкости) по трубе или какому-либо каналу в условиях сплошного потока, каждый кг этого газа (жидкости), кроме внутренней и внешних кинетической и потенциальных энергий, обладает еще дополнительной, переносимой на себя энергией проталкивания. РАБОТА РАСШИРЕНИЯ Работа против сил внешнего давления окружающей среды, связанная с увеличением объема системы называется работой расширения dl = p∙dv.
ТЕХНИЧЕСКАЯ РАБОТА Работа газа, находящегося в сплошном потоке, от подвода тепла dq при отсутствии трения будет состоять из работы расширения p∙dv и приращения энергии проталкивания (р∙v)
Поскольку в технических системах (тепловых двигателях, ТЭУ) все процессы работы совершаются, как правило, в непрерывном сплошном потоке, величину работы называют технической работой и обозначают через lтех. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ Всеобщий закон сохранения энергии и ее превращениях: энергия не исчезает и не возникает, она лишь переходит из одного вида в другой в различных процессах. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ 1 закон термодинамики характеризует процессы превращения энергии с количественной стороны. 1 закон термодинамики дает все необходимое для составления энергетического баланса какого-либо процесса, однако он не дает никаких указаний относительно возможности протекания того или иного процесса. 2 закон термодинамики характеризует качественную сторону этих процессов. Следует подчеркнуть, что 2 закон термодинамики сформулирован на основе опыта. Согласно этому закону, все самопроизвольные процессы в природе происходят всегда в определенном направлении и не могут без затрат энергии осуществляться в обратном направлении. ЭНТРОПИЯ Для идеальных процессов
для процессов с трением
Здесь ds – полный дифференциал, соответствующий приращению нового параметра, называемого энтропией. Энтропия S [кДж/К] относится к числу калорических параметров состояния и обладает свойством аддитивности. ТS – ДИАГРАММА Вводится диаграмма состояния с координатами Т и s, площадь под кривой процесса в которой всегда будет равна теплоте процесса.
СМЕСЬ идеальных ГАЗОВ Газовыми смесями называют механические смеси различных газов (чистых веществ). Парциальным давлением данного компонента газовой смеси называется давление, которое оказывает компонент при условии, что он занимает весь предоставленный для смеси объем при температуре смеси. Закон Дальтона: общее давление смеси газов равно сумме парциальных давлений всех компонентов, входящих в смесь
Изохорный процесс. В изохорном процессе выполняется условие Изобарный процесс. В изобарном процессе выполняется условие Изотермный процесс. При изотермном процессе выполняется условие Адиабатный процесс. Адиабатным называют процесс изменения состояния тела (или системы) без теплообмена с внешней средой. Для обратимых процессов, происходящих без трения dq = 0; q = 0; ds = 0 и s = const. Поэтому обратимые адиабатные процессы называют изоэнтропными.
Политропный процесс. Политропными процессами называют изменения состояний газа, вызываемые подводом или отводом тепла, а также совершением работы и происходящие при постоянстве теплоемкости. («Политропный» от греческих слов: «поли» – много, «тропос» – путь). Закон Нернста – Планка Теорема Нернста. Для конденсированных систем при T→0 (вблизи абсолютного нуля температуры) производные теплоты и работы по температуре становятся равными друг другу и стремятся к нулю. ПОтери эксергии Эксергия в реальных процессах в отличии от энергии не подчиняется закону сохранения. Если в рассматриваемой системе произойдет изменение энтропии еще каких–то тел системы, то в самом общем случае эксергетические потери равны
Зависимости между эксергией, энтропией и температурой позволяют графически ее изображать в Ts-диаграмме в виде соответствующих площадей. Эксергию подведенного тепла и ее потерю от необратимости теплообмена также удобно изображать с помощью графика η-q, не являющегося диаграммой состояния. По этому же принципу построена диаграмма состояний π-h, которая, сохраняя все свойства графика η-q, позволяет определять все другие параметры состояния тела. Для расчета эксергии тела можно также использовать hs–диаграмму, где эксергия выражается в виде разности величин, каждая из которых представляет собой эксергетический потенциал (h – Tо ∙ s), т.е. ex = (h1 – Tо ∙ s1) – (ho – Tо ∙ sо).
ВЛАЖНЫЙ ВОЗДУХ Основные определения. Влажным воздухом называется смесь сухого воздуха и водяного пара. Параметры влажного воздуха. Все расчеты с влажным воздухом производят с помощью уравнения Клапейрона, которому с достаточным приближением подчиняется ненасыщенный влажный воздух, что объясняется очень низким парциальным давлением водяного пара. Смешение газов и паров Смесь, состоящая из нескольких газообразных веществ, в реальных условиях получается их смешением одним из трех способов: смешением в заданном объеме; смешением в потоке; наполнением объема, содержащего один газ, потоком другого газа. При этом, как правило, теплота не подводится, т.е. происходит адиабатное смешение газов. Истечение идеального газа Химическое сродство. Совокупность всех условий, определяющих возможность осуществления данной реакции между несколькими веществами, называют химическим сродством. Лекция 17 Диссоциация газов и паров Диссоциацией называют распад химических соединений на более простые вещества, которыми, в частности, могут быть химические элементы. Одним из примеров диссоциации может служить распад СО2 на окись углерода СО и кислород О2 в реакции 2СО + О2 D 2СО2, а также распад молекул кислорода О2 на атомный кислород, происходящий при очень высоких температурах О2 D 2О. Лекция 18
Реакции горения топлив. ОСНОВНЫЕ ПОНЯТИЯ И ОПРЕДЕЛЕНИЯ Термодинамика, как самостоятельная наука, возникла в начале 19 века в связи с необходимостью теоретического обоснования тепловых процессов в паровых поршневых машинах. Основным содержанием термодинамики было изучение процессов взаимного превращения теплоты и механической работы, как двух форм обмена энергией. Техническая термодинамика (ТТД) изучает взаимное превращение тепловой и механической энергий с точки зрения применения этих превращений в технике, устанавливает пути достижения наибольшей полезной работы в различных тепловых двигателях и ТЭУ. Главным образом, ТТД исследует соотношения между параметрами термодинамических систем и совершаемой работой. ПАРАМЕТРЫ СОСТОЯНИЯ Параметры состояния – это характеристики состояния вещества, определяющие конкретные физические условия и однозначно определяющие состояние рассматриваемого вещества. Параметры состояния бывают интенсивные и экстенсивные. Интенсивные – параметры, не зависящие от количества вещества (давление, температура). Экстенсивные – параметры, зависящие от количества вещества (объем, внутренняя энергия, энтропия и др.). Все экстенсивные параметры обладают свойством аддитивности (суммироваться). Экстенсивные параметры приобретают свойства интенсивных, если их значения отнесены к единице количества вещества (удельные величины, отнесенные к 1 кг вещества; объемные величины, отнесенные к 1 м3 вещества; молярные величины, отнесенные к 1 кмоль вещества). Параметры, отражающие внутреннюю тепловую энергию, называют калорическими (внутренняя энергия, энтальпия, энтропия). Температура, давление и удельный объем являются основными параметрами состояния. Их также называют термическими параметрами состояния. ТЕРМОДИНАМИЧЕСКАЯ СИСТЕМА Термодинамической системой называется совокупность материальных тел, находящихся в тепловом и механическом взаимодействии. В ТТД материальные тела, входящие в состав системы, по их роли делят на горячие и холодные источники тепла (или теплоотдатчики и теплоприемники) и рабочие тела. ТЕРМОДИНАМИЧЕСКИЙ ПРОЦЕСС Термодинамическим процессом называется всякое изменение состояние тела или системы, связанное с тепловыми явлениями. Все процессы в термодинамической системе делятся на равновесные и неравновесные. ТЕПЛОТА И РАБОТА Изменение состояния термодинамической системы всегда связано с обменом энергией с окружающими ее телами. В рассматриваемых термодинамических процессах передача энергии происходит только в двух возможных формах – в форме теплоты и в форме работы. Количество энергии, переданной в форме хаотического (теплового) движения частиц, называют количеством тепла Q, или теплотой. Количество работы L, или также работой называют количество превращенной энергии из одного вида в другой. ТЕПЛОЕМКОСТЬ Теплоемкостью тела называется количество тепла, необходимое для нагрева тела на один градус, в данном процессе С = dQ / dТ, [Дж/К] где dQ – количество тепла, подведенное в каком-либо процессе. ВИДЫ ЭНЕРГИЙ Почти все виды энергии, рассматриваемые в ТТД, за исключением тепловой представляют собой энергию направленного движения. Механическая энергия – движение тел в пространстве. Электрическая энергия – движение электронов по проводнику. Химическая энергия – потенциальная энергия атомов, выделяющаяся при образовании новых молекул. Атомная (внутриядерная) энергия – потенциальная энергия, выделяющаяся при делении ядер атома или при синтезе. Свойством, присущим всем видам энергий, является способность каждого вида энергии переходить при определенных условиях в любой другой ее вид в строго определенном соотношении. Единица измерения – 1 Дж = 1 Н∙м = 1 кг∙м2/с2. Каждое тело в любом его состоянии может обладать одновременно различными видами энергии. При течении газа (или жидкости) по трубе или какому-либо каналу в условиях сплошного потока, каждый кг этого газа (жидкости), кроме внутренней и внешних кинетической и потенциальных энергий, обладает еще дополнительной, переносимой на себя энергией проталкивания. РАБОТА РАСШИРЕНИЯ Работа против сил внешнего давления окружающей среды, связанная с увеличением объема системы называется работой расширения dl = p∙dv.
ТЕХНИЧЕСКАЯ РАБОТА Работа газа, находящегося в сплошном потоке, от подвода тепла dq при отсутствии трения будет состоять из работы расширения p∙dv и приращения энергии проталкивания (р∙v)
Поскольку в технических системах (тепловых двигателях, ТЭУ) все процессы работы совершаются, как правило, в непрерывном сплошном потоке, величину работы называют технической работой и обозначают через lтех. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ Всеобщий закон сохранения энергии и ее превращениях: энергия не исчезает и не возникает, она лишь переходит из одного вида в другой в различных процессах. Уравнения 1 закона термодинамики для неподвижных тел
У равнения 1 закона термодинамики для потока имеют вид
ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ 1 закон термодинамики характеризует процессы превращения энергии с количественной стороны. 1 закон термодинамики дает все необходимое для составления энергетического баланса какого-либо процесса, однако он не дает никаких указаний относительно возможности протекания того или иного процесса. 2 закон термодинамики характеризует качественную сторону этих процессов. Следует подчеркнуть, что 2 закон термодинамики сформулирован на основе опыта. Согласно этому закону, все самопроизвольные процессы в природе происходят всегда в определенном направлении и не могут без затрат энергии осуществляться в обратном направлении.
|
||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 531; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.137.13 (0.009 с.) |

 .
. , (*)
, (*) . (**)
. (**) или
или  .
. , или
, или 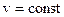 .
. , или
, или 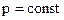 .
. или
или  .
.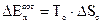 .
. ;
; ;
; .
. ;
; ;
;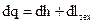 .
.


