
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обратимые и необратимые процессы ⇐ ПредыдущаяСтр 2 из 2
Обратимыми называют процессы, в результате совершения которых в прямом и обратном направлениях, термодинамическая система возвращается в исходное состояние. ЭНТРОПИЯ Для идеальных процессов
для процессов с трением
Здесь ds – полный дифференциал, соответствующий приращению нового параметра, называемого энтропией. Энтропия S [кДж/К] относится к числу калорических параметров состояния и обладает свойством аддитивности. ТS – ДИАГРАММА Вводится диаграмма состояния с координатами Т и s, площадь под кривой процесса в которой всегда будет равна теплоте процесса.
ТЕРМОДИНАМИЧЕСКИЕ СВОЙСТВА идеальных ГАЗОВ Идеальным называют гипотетический газ, который во всех областях возможных состояний строго подчиняется уравнению Менделеева-Клапейрона. Закон Авагадро: в одинаковых объемах разных газов при одинаковых температуре и давлении заключается одинаковое число молекул. Внутренняя тепловая энергия и энтальпия идеального газа.
Теплоемкости идеального газа.
СМЕСЬ идеальных ГАЗОВ Газовыми смесями называют механические смеси различных газов (чистых веществ). Парциальным давлением данного компонента газовой смеси называется давление, которое оказывает компонент при условии, что он занимает весь предоставленный для смеси объем при температуре смеси. Закон Дальтона: общее давление смеси газов равно сумме парциальных давлений всех компонентов, входящих в смесь
ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ ИДЕАЛЬНЫХ ГАЗОВ Исследование термодинамических процессов идеальных газов ставит своей целью разработать методы расчета параметров состояния системы в процессе, а также методы определения теплообмена q системы с внешней средой и количества работы l, свершаемой ее рабочим телом. Изохорный процесс. В изохорном процессе выполняется условие Изобарный процесс. В изобарном процессе выполняется условие Изотермный процесс. При изотермном процессе выполняется условие Адиабатный процесс. Адиабатным называют процесс изменения состояния тела (или системы) без теплообмена с внешней средой. Для обратимых процессов, происходящих без трения dq = 0; q = 0; ds = 0 и s = const. Поэтому обратимые адиабатные процессы называют изоэнтропными.
Политропный процесс. Политропными процессами называют изменения состояний газа, вызываемые подводом или отводом тепла, а также совершением работы и происходящие при постоянстве теплоемкости. («Политропный» от греческих слов: «поли» – много, «тропос» – путь). Термодинамические потенциалы При рассмотрении термодинамических систем, в которых происходят фазовые превращения вещества из одного состояния в другое или из одного химического состояния в другое приведенных шести параметров состояния (p, V, T, U, H, S) оказывается недостаточно. Такие процессы происходят, как правило, при сохранении постоянными одновременно двух основных параметров состояния. Так, фазовые превращения, например, превращение нагретой до кипения воды в насыщенный пар происходит при одновременном постоянстве р и Т. Химические реакции осуществляются при постоянстве двух параметров р и Т или V и T. Термодинамическую функцию (U – T·S) называют свободной энергией (энергией Гельмгольца) или изохорно – изотермным потенциалом, и обозначают F = U – T·S. Термодинамическую функцию (H – T·S) называют изобарно–изотермнымпотенциалом или потенциалом (энергией) Гиббса и обозначают Ф = Н – Т·S. Одновременно термодинамические потенциалы F и Ф являются характеристическими функциями, частные производные, которых являются параметрами состояния. Удельные термодинамические потенциалы: для систем при р = const и Т = const → для систем при V = const и Т = const →
Закон Нернста – Планка Теорема Нернста. Для конденсированных систем при T→0 (вблизи абсолютного нуля температуры) производные теплоты и работы по температуре становятся равными друг другу и стремятся к нулю.
|
|||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 148; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.107.161 (0.007 с.) |
 , (*)
, (*) . (**)
. (**) .
.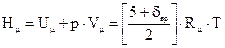 .
. ,
, .
. или
или  .
. , или
, или 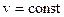 .
. , или
, или 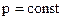 .
. или
или  .
.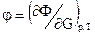 ;
; .
.


