Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
К практическим занятиям по медицинской химииСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Кафедра медицинской химии
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
К практическим занятиям по медицинской химии для студентов первого курса международного медицинского факультета.
Донецк - 2011 Методические указания подготовили: - зав. кафедрой, доцент Рождественский Е.Ю. - доцент Сидун М.С., - ст. преподаватель Павленко В.И., - ассистенты кафедры Игнатьева В.В., Бойцова В.Е., Бусурина З.А., Стрелецкая Л.П., Сидоренко Л.М.
Методические указания утверждены на заседании Ученого Совета Дон НМУ им. М. Горького 24.06.2011 г., протокол №5.
Рецензенты: 1. Д.м.н., зав. каф. патологической физиологии, профессор Ельский В.М. 2. Д.х.н.,зав.каф.фармацевтической и токсикологической химии Матвиенко А.Г.
Введение.
Целью развития отечественного образования в настоящее время является его конкурентноспособность по отношению к европейской системе образования. В 1999 года в европейской школе высшего образования был принят Болонский процесс. Основным принципом, которого является создания единого общеобразовательного пространства. Поскольку Украина - участник этого процесса, это влечет за собою изменение образовательных программ в высших учебных заведениях, а так же дает возможность нашим студентам получать высшее образование на уровне европейских стандартов. Методические указания, которые предлагаются Вашему вниманию, должны помочь в освоении курса медицинской химии и формированию умений, необходимых в учебной и будущей профессиональной деятельности. В связи с этим методические указания имеют определенную структуру. Каждый раздел начинается с обоснованияактуальности и значения темы в медицине и биологии. Затем формулируются цели изучения конкретного раздела, отображающие умения, которые необходимо приобрести, и обеспечивают управление внеаудиторной подготовкой к практическим занятиям. Теоретические вопросы к темам помогут овладеть содержанием, без знания которого невозможно выполнения целевых видов деятельности. В списках литературы указаны источники для изучения конкретных тем. Освоению материала оказывают содействие структурно-логические схемы содержания (графы). Методические указания содержат ситуационные задачи, сформулированные соответственно целям освоения учебного материала. Задания предлагается выполнить самостоятельно. Решения этих заданий способствует проверке степени готовности к занятиям. Краткие методические указания, которые завершают каждую тему, дают возможность определить последовательность, этапы, их продолжительность и обеспечение занятий. Эти методические рекомендации помогут осуществить качественную подготовку студентов соответственно требованиям кафедры. Изучение разделов предмета и коррекция знаний помогут будущим медикам освоить медицинскую химию как теоретическую базу для изучения таких фундаментальных дисциплин как биохимия, фармацевтическая химия. Мы надеемся, что самостоятельная работа студентов и контроль ее обеспечит приобретения знаний на качественно более высоком уровне, помогут использовать полученные знания при решении конкретных задач, которые будут встречаться в их врачебной практике. Участие в Болонской системе предоставляет возможность достойно проявить себя не только в профессиональной деятельности, но и на рынке труда. В конце хотелось отметить только знания химических, физических биологических законов поможет будущим врачам оценить значение важнейшей проблемы, стоящей сейчас перед человечеством – сохранение здоровья людей. ПЕРИОДИЧЕСКИЙ ЗАКОН Д.И. МЕНДЕЛЕЕВА. ОСНОВНЫЕ КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ.
АКТУАЛЬНОСТЬ ТЕМЫ. Отличительная черта современной медицины – активное внедрение достижений химии в теорию и практику исследований функций живого организма. Еще великий ученый М.В. Ломоносов говорил, что «понимаемые в глубоком смысле химия и медицина неотделимы». Медицинская химия изучает химические основы процессов жизнедеятельности живого организма, которые подчиняются основным химическим закономерностям. Большинство процессов, происходящих в живом организме, объясняется на основании теоретических положений неорганической, физической и коллоидной химии. Например, изменение структуры и функций клеток крови в растворах кровезаменителей объясняется законами осмотического давления. Не менее важную роль играют законы кинетики и катализа, которые дают возможность понимать закономерности протекания ферментативных процессов. Поэтому особую роль приобретает знание основ медицинской химии, которая служит фундаментом при последующем изучении биоорганической и биологической химии, фармакологии, физиологии, гистологии, санитарии и гигиены, анестезиологии. Прогресс современной медицины во многом обусловлен достижениями в химии. Положительный эффект врачебной деятельности на 70% определяется наличием лекарственных препаратов, большинство которых синтезировано химиками. Периодический закон и созданная на его основе периодическая система элементов Д.И. Менделеева являются одним из основных законов естествознания, фундаментом современного учения о строении материи. Химия получила теоретический фундамент и приобрела черты современной науки. Значение этого закона выходит далеко за пределы химии. Так, успехи атомной и ядерной физики атома стали возможны лишь благодаря периодическому закону. С другой стороны, развитие квантовой механики расширили и углубили содержание закона. В окружающей природе, в живом организме химические элементы образуют большое число неорганических соединений. Их классификация позволяет проследить закономерности изменений свойств соединений, выявить взаимосвязь между ними, произвести обобщение. Это помогает изучению большого объема фактического материала и дает возможность прогнозировать протекание той или иной реакции между веществами. В периодической системе элементов нашли своё подтверждение все основные законы философии: закон единства и борьбы противоположностей, переход количества в качество, отрицание отрицания. Знание периодического закона и периодической системы Д.И. Менделеева, а также основных классов неорганических соединений необходимы студентам для дальнейшего изучения ими курсов биохимии, фармакологии и клинических дисциплин. ЦЕЛИ ОБУЧЕНИЯ. ОБЩАЯ ЦЕЛЬ. Уметь трактовать периодическую систему Д.И. Менделеева для составления электронных и электронно-графических формул элементов и на основании положения элемента в системе характеризовать его свойства и свойства его важнейших соединений, а так же анализировать основные классы неорганических соединений.
КОНКРЕТНЫЕ ЦЕЛИ. УМЕТЬ: 1. Интерпретировать понятия период, группа, подгруппа. 2. Интерпретировать сущность порядкового номера элемента, периодичность изменения свойств элементов, а также понятий: потенциал ионизации, сродство к электрону, электроотрицательность, радиус атома и ионов. 3. Интерпретировать изменение металлических и неметаллических, окислительно-восстановительных свойств элементов в группах и периодах. 4. Интерпретировать оксиды, гидроксиды, кислоты и соли. 5. Трактовать зависимость кислотно-основных свойств оксидов и гидроксидов от положения элемента в периодической системе Д.И. Менделеева.
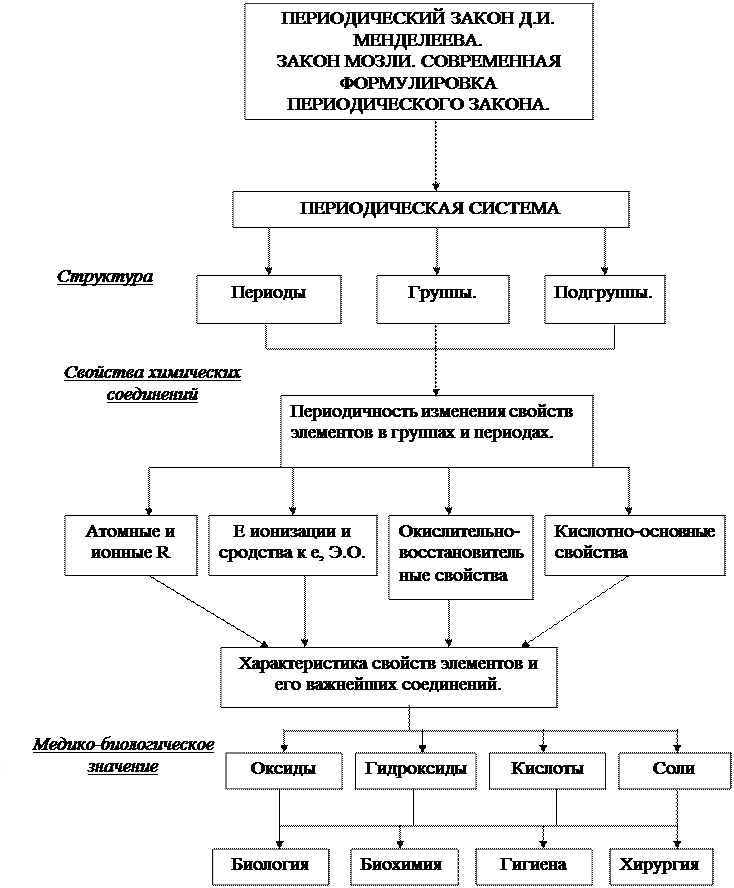
СОДЕРЖАНИЕ ОБУЧЕНИЯ. 1. ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ. 1. Вступление к практикуму. Роль курса медицинской химии. 2. Развитие периодического закона. Закон Мозли. Современная трактовка периодического закона. 3. Структура периодической системы и её обоснование с позиций теории строения атома. 4. Периодичность изменения свойств атомов: атомных и ионных радиусов, потенциала ионизации, энергии ионизации, энергии сродства к электрону, электроотрицательности. 5. Классы оксидов, гидроксидов, кислот и солей. Их классификация. 6. Изменение окислительно-восстановительных, кислотно-основных свойств кислородных соединений, устойчивости водородных соединений. 7. Роль периодического системы Д.И. Менделеева в современной химии.
2. ГРАФ ЛОГИЧЕСКОЙ СТРУКТУРЫ ТЕМЫ.
3. ИСТОЧНИКИ ИНФОРМАЦИИ. Основная литература. 1. Медицинская химия: учебник. Калибабчук В.А., Грищенко Л.И., Галинская В.И. и др. – К.: Медицина, 2008. – С. 7-24. 2. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. – Вінниця: Нова книга, 2006. – С. 20-44. Дополнительная литература. 3. Левітін Є.Я., Бризицька А.М., Клюєва Р.Г. Загальна та неорганічна хімія. Підручник. – Вінниця: Нова книга, 2003. – С. 41-60, 99-125. 4. Н.И. Михайличенко. Общетеоретические основы химии. – К.: Высшая школа, 1979. – С. 35-49. 5. Ершов Ю.А., Попков В.А., Берлянд А.З. Общая химии. Биофизическая химия. Химия биогенных элементов. Учебник для ВУЗов. – М.: Высшая школа, 2000. – С. 153-164. 6. Ахметов Н.С. Общая и неорганическая химия. Учебник для ВУЗов. – М.: Высшая школа, изд. центр «Академия», 2001. – С. 27-45. Задача 1. Напишите электронные формулы атомов элементов с порядковыми номерами 20 и 50 и укажите к каким элементам они относятся. Эталон решения: Элементы с порядковыми номерами 20 и 50 в периодической системе – это кальций и олово. Порядковый номер элемента показывает заряд ядра и число электронов в атоме. Используя номер периода, в котором находится каждый из элементов, их электронные формулы можно изобразить: Са KL 3s23p64s2; Кальций – s-элемент; Sn KLM 4s24p65s2; Олово – р-элемент. Задача 2. Напишите электронные формулы атомов хлора и стронция, и их ионов Сl–, Sr2+. Эталон решения: Электронные формулы атомов элементов имеют вид: Сl KL 3s23p5; Sr KLM 4s24p65s2. Атом хлора, принимая электрон, превращается в однозарядный ион с восьмиэлектронной внешней оболочкой, а атом стронция, отдавая 2 электрона превращается в двузарядный катион. Электронные формулы ионов имеют вид: Сl– KL 3s23p6; Sn2+ KLM 4s24p65s0.
Задача 3. Пользуясь правилом Клечковского и положением элементов в периодической системе, укажите, нейтральным атомам каких элементов, отвечают электронные формулы: KL 3s23p63d14s2 и KLM 4s24p2. Приведите формулы их ионов Е3+ и Е2+. Эталон решения: Значения главного квантового числа внешнего электронного уровня указывают на то, что элементы находятся в 4-м периоде, причем один из них d-элемент, а другой – р-элемент, на это указывают незаполненные d-орбитали и соответственно р-орбитали. Число валентных электронов 3d14s2 и 4s24p2 подтверждают, что эти элементы соответственно 3-ей и 4-ой групп периодической системы. Значит это элементы – скандий и германий. Для получения катиона Sc3+ из атома нужно удалить два s- и один d-электрон, для получения катиона германия необходимо удалить из нейтрального атома два р-электрона. Тогда электронные формулы ионов имеют вид: Sc3+ KL 3s23p63d104s0; Ge2+ KLM 4s24p0.
Задача 4. Дайте сравнительную характеристику элементов хлора и марганца. Эталон решения: Хлор и марганец – элементы седьмой группы, атомы которых имеют одинаковые число валентных электронов, равное номеру группы. Высшая степень окисления элементов +7, поэтому формулы высших оксидов – Cl2O7 и Mn2O7. Они характеризуются кислотными свойствами, в качестве гидроксидов им соответствуют сильные кислоты HClO4 и HMnO4. Валентные электроны этих элементов находятся на разных энергетических уровнях: у атома хлора это s- и р-электроны внешнего уровня, для завершения которого не хватает одного электрона. Поэтому хлор – типичный неметалл, сильный окислитель. У атома марганца валентные 2 s-электрона внешнего 5 d-электронов предпоследнего энергетических уровней, поэтому марганец – типичный металл, сильный восстановитель. Соединения этих элементов в низших степенях окисления отличаются по свойствам. Низший оксид марганца MnO – основной оксид, которому соответствует слабое основание Mn(OH)2, а низший оксид хлора Cl2O – кислотный оксид, ангидрид слабой хлорноватистой кислоты HClO.
Задача 5. Назовите валентные электроны атомов s-, p-, d-, f-элементов. Подчеркните их в электронных формулах атомов элементов с порядковыми номерами 5,15,17,24,25,35 и укажите, к каким электронным семействам они принадлежат.
Задача 6. Напишите электронные формулы ионов элементов 4-ого периода аналогов аргона. Задача 7. Объясните причину «проскока» внешнего s-электрона в атомах хрома и меди.
Задача 8. Напишите формулы высших оксидов и гидроксидов элементов третьего периода и охарактеризуйте порядок изменения кислотно-основных свойств этих веществ с увеличением заряда ядра атома.
Задача 9. Разместите гидроксиды в порядке возрастания основных свойств: NaOH, CsOH, Ca(OH)2, Ba(OH)2, Zn(OH)2, Cd (OH)2.
Задача 10. Пользуясь положением элементов в периодической системе, определите какой из гидроксидов более сильное основание Sn(OH)2 или Pb(OH)2.
Задача 11. Укажите символы химических элементов, ионам которых отвечают электронные формулы: E–2 [He] 2s22p6 E– [Ne] 3s23p6 E+2 [Ne] [Ar]3d5; [Ar] 3d2; [Ar] 3d3 Задача 12. На основании электронного строения атомов дайте сравнительную характеристику элементов хрому и сере.
Задание 1. Элементы характеризуются определенной периодичностью в изменении их свойств в периодической системе. Укажите фактор, определяющий эти изменения. A. Заряд атома B. Степень окисления C. Валентность D. Атомный радиус E. Электроотрицательность
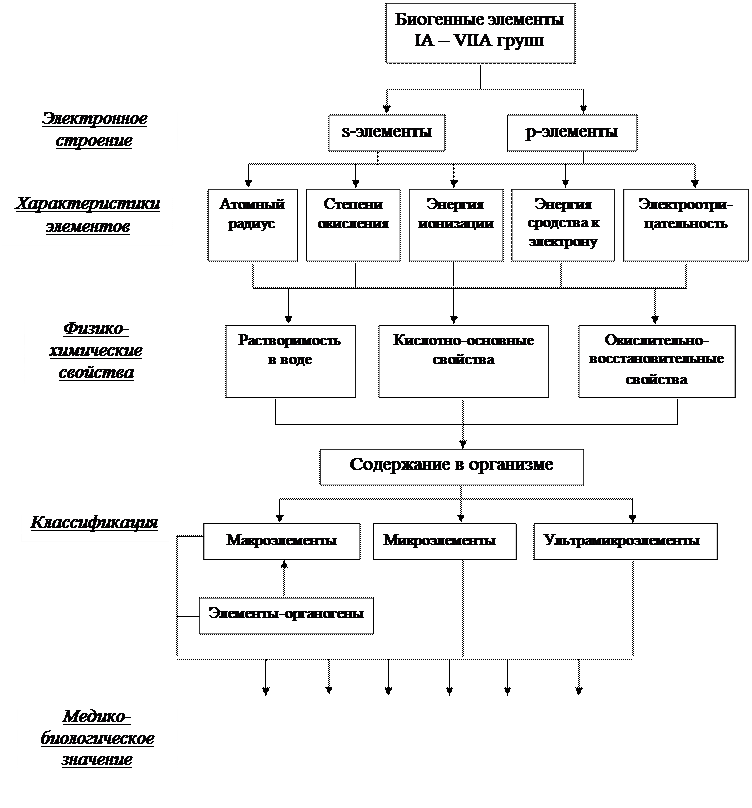
Задание 2. Одна из классификаций химических элементов основана на строении их электронных оболочек. Согласно неё все элементы можно разделить на s-, p-, d- и f-элементы. Укажите р-элементы. A. S, P, Cl B. K, Ca, Se C. Ba, Mg, Al D. Mn, Br, Mo E. P, S, Cr Задание 3. Все водородные соединения элементов V-A группы обладают токсичностью. Укажите наиболее стойкие летучие водородные соединения. A. NH3 B. PH3 C. AsH3 D. SbH3 E. BiH3 Задание 4. Свойства ионов зависят от их положения в периодической системе. Укажите, как изменяются восстановительные свойства в ряду: Сl– – Br– – I– A. Уменьшаются B. Увеличиваются C. Не изменяются D. Бром сильный восстановитель, чем хлор E. Не проявляют восстановительных свойств Задание 5. Основные свойства гидроксидов определяются положением элемента в периодической системе. Укажите, какой из перечисленных гидроксидов имеет наиболее выраженные основные свойства. A. CsOH B. LiOH C. KOH D. Ca(OH)2 E. Mg(OH)2 Задание 6. Степень окисления элемента определяется его электронной структурой, которая зависит от положения элемента в периодической системе. Укажите элемент, который имеет только положительную степень окисления. A. Магний B. Сера C. Хлор D. Кислород E. Фтор Задание 7. Сила галогеноводородных кислот зависит от положения кислотообразующего элемента в периодической системе. Укажите, какая из ниже приведенных кислот является наиболее сильной. A. HF B. HBr C. HI D. HCl E. HBi Задание 8. Все элементы в периодической системе располагаются в больших и малых периодах. Укажите наличие какого фактора отличает их друг от друга. A. d- и f-элементы B. металлы C. инертные газы D. s-элементы E. неметаллы Задание 9. К р-элементам IV группы периодической системы относятся углерод, кремний, германий, олово и свинец. Укажите, как изменяются кислотные свойства элементов в этом ряду. A. Увеличиваются B. Уменьшаются C. Не изменяются D. Сначала увеличиваются, потом уменьшаются E. Сначала уменьшаются, потом увеличиваются Задание 10. Соединение меди CuSO4∙5H2O используется в фармации в качестве бактерицидного препарата. Какая формула отвечает электронной конфигурации элемента 29Cu? A. 3d104s1 B. 3d94s2 C. 3d64s2 D. 3d84s2 E. 3d74s2 Задание 11. Для количественного определения многих лекарственных средств используют неводные растворы хлорной кислоты. Какой из приведенных оксидов соответствует этой кислоте? A. Cl2O7 B. ClO C. ClO2 D. Cl2O3 E. CI2O6 Задание 12. Малотоксичный оксид азота под названием «веселящий газ» применяется в медицине для наркоза при хирургических операциях. Выберите это соединение. A. NO B. NO2 C. N2O D. N2O3 E. N2O5 Эталоны ответов. 1 – А; 5 – B; 9 – B; 2 – A; 6 – A; 10 – A; 3 – A; 7 – C; 11 – A; 4 – B; 8 – A; 12 – C. АКТУАЛЬНОСТЬ ТЕМЫ. Биогенные элементы – химические элементы, необходимые для построения и жизнедеятельности клеток и тканей организмов. Основу всех живых систем составляют шесть элементов-органогенов: углерод, водород, кислород, азот, фосфор, сера. Их содержание в организме достигает 97%. Физиологическая роль биогенных элементов определяется их физико-химическими свойствами, которые обусловлены положением элемента в периодической системе Д. И. Менделеева. s- и p-элементы – это элементы главных подгрупп І –VII групп периодической системы. Каждый период системы начинается двумя s-элементами, а шесть его последних элементов (кроме первого периода) – это p-элементы. В организме человека в значительном количестве содержатся лёгкие s- и р-элементы. Так, к незаменимым макроэлементам принадлежат s-элементы первого (Н) периода, а также s-элементы третьего (Na, Mg) и четвёртого (K, Ca) периодов, которые являются биометаллами. Их ионы входят в состав буферных систем организма, обеспечивают необходимое осмотическое давление, участвуют в образовании мембранных потенциалов, в передаче нервных импульсов (Na+, K+), структурообразовании (Mg2+, Ca2+). Такие s-элементы, как бериллий, барий обладают особо токсическими свойствами. Среди p-элементов пять элементов второго (C, N, O) и третьего (P, S) периодов являются органогенами («элементами жизни»), составляющими основу биологически важных молекул. К биогенным элементам относятся также хлор и йод, а бор, фтор, бром находятся в живых организмах в микроколичествах и являются примесными элементами. Соединения свинца и мышьяка обладают особо токсическими свойствами. Как правило, в живом организме р-элементы входят в состав сложных органических макромолекул или ионов: OH-, Cl-, SO42-, HCO3-, H2PO4-, HPO42-, F-. Они составляют основу буферной системы крови, обеспечивают необходимое осмотическое давление, содержатся в желудочном соке и других биологических средах. Многие соединения s- и p-элементов представляют собой основу для синтеза фармацевтических препаратов. Поэтому знание физико-химических свойств биогенных s- и р-элементов и их соединений необходимо для диагностики, профилактики и лечения болезней, вызванных избытком или недостатком этих элементов в организме. ЦЕЛИ ОБУЧЕНИЯ. ОБЩАЯ ЦЕЛЬ. Уметь интерпретировать физико-химические свойства, биохимическую роль и медико-биологическое значение биогенных элементов IA – VIIA групп (s- и р-элементов) на основе электронного строения их атомов.
КОНКРЕТНЫЕ ЦЕЛИ. УМЕТЬ: 1. Интерпретировать общую характеристику и медико-биологическое значение биогенных элементов, исходя из электронного строения их атомов. 2. Интерпретировать физико-химические свойства биогенных s- и р-элементов ІА - VIIA групп на основе электронного строения их атомов и положения в периодической системе Д. И. Менделеева. 3. Интерпретировать биохимическую роль и медико-биологическое значение биогенных s-элементов, исходя из их свойств и содержания в организме. 4. Интерпретировать биохимическую роль и медико-биологическое значение биогенных р-элементов, исходя из их свойств и содержания в организме. 5. Трактовать аналитические реакции биогенных s- и р-элементов IA – VIIA групп.
СОДЕРЖАНИЕ ОБУЧЕНИЯ. 1. ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ. 1. Определение и классификация биогенных элементов. Общая характеристика биогенных элементов, исходя из электронного строения их атомов, содержание в организме и биохимическая роль. 2. Общая характеристика биогенных s- и р-элементов IA – VIIA групп: - положение в периодической системе элементов Д. И. Менделеева; - электронная конфигурация атомов элементов; - характерные степени окисления; - изменение кислотно-основных и окислительно-восстановительных свойств в группах и периодах. 3. Биохимическая роль и медико-биологическое значение биогенных s-элементов (водород, литий, натрий, калий, магний, кальций). 4. Биохимическая роль и медико-биологическое значение биогенных р-элементов (углерод, азот, фосфор, кислород, сера, фтор, хлор, бром, йод, алюминий, мышьяк, бор). 5. Аналитические реакции открытия биологически активных ионов s- и р-элементов. 2. ГРАФ ЛОГИЧЕСКОЙ СТРУКТУРЫ ТЕМЫ.
3. ИСТОЧНИКИ ИНФОРМАЦИИ. Основная литература. 1. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. – Вінниця: Нова книга, 2006. – С. 210-225, 257-282, 288-292. 2. Калибабчук В.А., Грищенко Л.И., Галинская В.И. и др. Медицинская химия: учебник. – К.: Медицина, 2008. – С. 342-379. Дополнительная литература. 3. Левітін Є.Я., Бризицька А.М., Клюєва Р.Г. Загальна та неорганічна хімія. Підручник. – Вінниця: Нова книга, 2003. – С. 272-278, 291-293, 298-299, 309, 310-311, 321-322, 340-341, 355, 363, 369, 376-377, 390-391, 408-409. 4. Ахметов Н.С. Общая и неорганическая химия. Учебник для ВУЗов. – М.: Высшая школа, изд. центр «Академия», 2001. – С. 289-541. 5. Хухрянский В.Г., Цыганенко А.Я., Павленко Н.В. Химия биогенных элементов. Киев: Вища школа, 1984. – С.12-49; 107-150. 6. Л.П. Садовничая, В.Г. Хухрянский, А.Я. Цыганенко. Биофизическая химия. – К.: Вища шк. Головное изд-во, 1986. – С. 130-135. 7. К.А. Селезнёв. Аналитическая химия. М.: «Высшая школа», 1973. – С.72-73, 78-79, 85, 90-91, 108, 142-143, 153.
Задание 1. Основу всех живых систем составляют шесть элементов-органогенов. Определите эти элементы. A. C, N, As, B, Al, Cl; B. H, P, S, C, O, N; C. O, Cl, Na, K, Ca, Mg; D. H, F, Br, Bi, As, I; E. O, K, Li, B, F, Se.
Задание 2. Один из s-элементов расположен в периодической системе Д.И. Менделеева под порядковым номером 12. Укажите электронную конфигурацию, которая отвечает этому элементу. A. 1s22s22p63s23p1; B. 1s22s22p63s2; C. 1s22s22p63s1; D. 1s22s22p1; E. 1s22s22p3.
Задание 3. Фосфор – незаменимый элемент, входящий в состав гидрофосфат- и дигидрофосфат-ионов фосфатной буферной системы организма. Укажите электронную конфигурацию, которая отвечает атому фосфора в составе этих ионов. A. 1s22s22p63s23p64s1; B. 1s22s22p63s23p4; C. 1s22s22p6; D. 1s22s22p63s23p2; E. 1s22s22p63s23p3. Задание 4. Хлор – биогенный р-элемент, способный образовывать анионы различной степени устойчивости. Укажите анион, который обладает наименьшей окислительной активностью. A. Cl-; B. ClO-; C. ClO2-; D. ClO3-; E. ClO4-.
Задание 5. В поддержании постоянного осмотического давления биожидкостей (осмотического гомеостаза) принимают участие различные биогенные элементы. Укажите ион s-элемента, который играет в этом процессе ведущую роль. A. Li+; B. Na+; C. Mg2+; D. Ca2+; E. Ba2+.
Задание 6. С целью сокращения времени срастания костей при переломе врач назначил препарат, в состав которого входит биогенный s-элемент. Определите этот элемент. A. Li; B. Na; C. K; D. Ca; E. Mg.
Задание 7. Процесс дыхания сопровождается превращением гемоглобина в оксигемоглобин. Определите биогенный p-элемент, который осуществляет это превращение. A. N; B. S; C. O; D. Cl; E. P. Задание 8. Макроэргические соединения являются основными источниками энергии в организме. Определите р-элемент, который является обязательным структурным компонентом этих соединений. A. P; B. S; C. Cl; D. N; E. F.
Задание 9. При проведении качественной реакции на содержание ионов Са2+ в моче выпал белый мелкокристаллический осадок, не растворимый в уксусной кислоте, но растворимый в азотной кислоте. Определите химический состав образовавшегося осадка. A. CaCO3; B. CaC2O4; C. CaSiO3; D. Ca3(PO4)2; E. CaSO3.
Задание 10. При добавлении раствора дифениламина к морковному соку образовался продукт интенсивно синего цвета. Укажите присутствие каких ионов в соке дает данный аналитический эффект. A. Cl-; B. PO43-; C. C2O42-; D. NO3-; E. I-. Эталоны ответов. 1 – B, 5 – B, 9 – B, 2 – C, 6 – D, 10 – D. 3 – C, 7 – C, 4 – E, 8 – A, АКТУАЛЬНОСТЬ ТЕМЫ. К d-блоку относятся 32 элемента периодической системы, расположенные в четвертом ─ седьмом больших периодах. Они называются переходными элементами, так как занимают переходное положение между s-элементами, начинающими каждый период, и р-элементами, его завершающими. Присутствующие в организме человека биогенные d-элементы являются металлами - микроэлементами, т.е. их содержание в тканях составляет менее 10-2 %. Жизненно необходимые биогенные d-элементы Zn, Cu, Fe, Mn, Co, Mo называются металлами жизни. Общими свойствами металлов – микроэлементов являются: 1) широкая распространённость в природе, доступность и легкая усвояемость организмом; 2) высокая комплексообразующая способность относительно различных донорных атомов, обладание различными устойчивыми степенями окисления и возможность легкого перехода из одной степени окисления в другую. Эти свойства биогенных d-элементов обеспечивают их активное участие в важнейших биохимических процессах в клетке: 1) ферментативный катализ реакций синтеза и реакций клеточной энергетики; 2) перенос электронов, ионов, молекул и молекулярных ферментов; 3) регулирование активности механизмов и систем клетки. В биохимических реакциях организма d-элементы принимают участие в виде бионеорганических комплексов металлов, таких как гемоглобин, цитохромы, ферритин, цианкобаламин (витамин В12), церулоплазмин, супероксиддисмутаза (СОД), цитохромоксидаза, карбоангидраза и др. Соединения, содержащие в своем составе d-элементы, широко используются в медицинской практике. Например, комплексоны, в состав которых могут входить Fe, Ca, Cu, Cd, Hg, Pb, Be и др. применяются в терапии для поддержания металло-лигандного гомеостаза и выведения из организма ионов токсических металлов; в санитарно-гигиенических исследованиях - при анализе качества воды. Коллоидные препараты серебра (протаргол, колларгол) применяются в офтальмологии для лечения конъюнктивитов, для лечения инфекционных, кожных и венерических заболеваний. Сплавы, содержащие медь, серебро, олово применяются в стоматологии, хирургии и других областях медицины.
ЦЕЛИ ОБУЧЕНИЯ. ОБЩАЯ ЦЕЛЬ. Уметь трактовать общую характеристику d-элементов, их свойства и биологическую роль исходя из электронного строения атомов d-элементов.
КОНКРЕТНЫЕ ЦЕЛИ УМЕТЬ: 1. Интерпретировать общую характеристику d-элементов, исходя из электронного строения атомов d-элементов. 2. Интерпретировать изменение степеней окисления, окислительно-восстановительных и кислотно-основных свойств d-элементов. 3. Интерпретировать роль d-элементов в реакциях комплексообразования. 4. Интерпретировать аналитические реакции биогенных d-элементов. 5. Трактовать химические основы применения переходных элементов и их соединений в биологии, медицине и фармации.
СОДЕРЖАНИЕ ОБУЧЕНИЯ. 1. ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ. 1. Положение d-элементов в периодической системе Д.И.Менделеева. Особенности электронного строения d-элементов и их связь с положением в периодической системе. 2. Особенности изменения степеней окисления, окислительно-восстановительных и кислотно-основных свойств d-элементов. 3. Роль d-элементов в реакциях комплексообразования. 4. Аналитическая реакция на ионы биогенных d-элементов. 5. Биологическая роль d-элементов. Применение переходных элементов и их соединений в медицине и фармации. 2. ГРАФ ЛОГИЧЕСКОЙ СТРУКТУРЫ ТЕМЫ.
3. ИСТОЧНИКИ ИНФОРМАЦИИ. Основная литература. 1. Мороз А.С., Луцевич Д.Д., Яворська Л.П. Медична хімія. – Вінниця: Нова книга, 2006. – С.225-254; 292-313. 2. Калибабчук В.А., Грищенко Л.И., Галинская В.И. и др. Медицинская химия: учебник – К.: Медицина, 2008. – С. 379- 392. Дополнительная литература. 3. Левітін Є.Я., Бризицька А.М., Клюєва Р.Г. Загальна та неорганічна хімія. Підручник. – Вінниця: Нова книга, 2003. – С. 414; 423-425; 432; 433; 442; 444; 451; 453; 459. 4. Ахметов Н.С. Общая и неорганическая химия. Учебник для ВУЗов. – М.: Высшая школа, изд. центр «Академия», 2001. – С. 546-549. 5. Хухрянский В.Г., Цыганенко А.Я., Павленко Н.В. Химия биогенных элементов. Киев: Вища школа, 1984. – С. 60-100. 6. К.А. Селезнёв. Аналитическая химия. М.: «Высшая школа», 1973. – С. 41-60, 92-100, 114-116.
Образование нерастворимых в воде гидроксидов d-элементов. Принцип метода: Метод основан на образовании нерастворимых в воде осадков гидроксидов железа (III), хрома (III), меди (II) и цинка (II), имеющих разную окраску и свойства. Материальное обеспечение: пробирки,растворы солей хлорида железа (III),сульфата хрома (ІІІ), сульфата меди (II), хлорида цинка (ІІ), раствор гидроксида калия (2М), раствор соляной кислоты (2М). Ход работы: 1. В отдельные пробирки поместить по 2-3 капли растворов хлорида железа (ІІІ), сульфата хрома (ІІІ), сульфата меди (ІІ), хлорида цинка (ІІ). 2. В каждую пробирку внести 1 каплю 2 М раствора гидроксида калия. 3. Отметить цвет образовавшихся осадков. 4. Содержимое каждой из пробирок разделить поровну на 2 пробирки. 5. Внести в первую пробирку 1-2 капли 2 М раствора гидроксида калия. 6. Внести во вторую пробирку 1-2 капли 2 Н раствора соляной кислоты. 7. Отметить те пробирки, в которых осадок растворился и те, в которых осадок не растворился. 8. Составить уравнения соответствующих реакций в молекулярном и ионном виде. 9. Сделать вывод о свойствах образовавшихся гидроксидов d-элементов. Опыт №2. Действие раствора аммиака на растворы солей d-элементов. Принцип метода: метод основанна образовании гидроксидов меди (ІІ), цинка (ІІ), кобальта (ІІ), которые, растворяясь в избытке реактива, образуют комплексные соединения. Материальное обеспечение: пробирки, растворы сульфата меди (ІІ), хлорида цинка (ІІ), сульфата кобальта (ІІ), раствор аммиака (2М). Ход работы: 1. В отдельные пробирки поместить по 3 капли растворов сульфата меди (ІІ), хлорида цинка (ІІ) и сульфата кобальта (ІІ). 2. Внести в каждую пробирку по 1 капле 2М раствора аммиака. 3. Отметить цвет образовавшихся солей. 4. Внести в каждую пробирку по 6 капель концентрированного раствора аммиака. 5. Отметить изменения, происходящие в каждой из пробирок. 6. Составить уравнения соответствующих реакций в молекулярном и ионном виде. 7. Определить тип образовавшихся комплексных соединений и назвать эти соединения.
Опыт №3. Образование нерастворимых гексацианоферратов Fe2+, Fe3+, Zn2+ . Принцип метода: метод основан на взаимодействии солей Fe2+, Fe3+ и Zn2+ с соответствующими аналитическими реагентами с образованием в кислой среде осадков комплексных соединений различной окраски. Материальное обеспечение: пробирки, растворы сульфата железа (ІІ), хлорида железа (ІІІ), хлорида цинка (ІІ), раствор гексацианоферрата (II) калия (желтой кровяной соли) К4 [Fe(CN)6], раствор гексацианоферрата (III) калия (красной кровяной соли) К3[Fe(CN)6]. Ход работы: 1. Поместить в отдельные пробирки по 3 капли растворов солей сульфата железа (II), хлорида железа (III) и хлорида цинка (II). 2. Внести в пробирку с раствором сульфата железа (II) 1 каплю раствора К3[Fe(CN)6] (красной кровяной соли). 3. Внести в пробирку с раствором хлорида железа (III) 1 каплю раствора К4[Fe(CN)6] (желтой кровяной соли). 4. Внести в пробирку с раствором хлорида цинка (II) 1 каплю раствора К4[Fe(CN)6] (желтой кровяной соли). 5. Отметить цвет осадка, образовавшегося в каждой из пробирок. 6. Составить уравнения соответствующих реакций в молекулярном и ионном виде. Опыт №4. Образование тиоцианатного комплекса Fe3+. Принцип метода: метод основан на взаимодействии кислых растворов солей железа (ІІІ) с раствором роданида калия, которое сопровождается образованием растворимого в воде роданида железа кроваво-красного цвета. Материальное обеспечение: пробирки, раствор хлорида железа (ІІІ), раствор роданида калия KSCN. Ход работы: 1. В пробирку внести 3 капли раствора хлорида железа (ІІІ). 2. Добавить 1 каплю раствора роданида калия. 3. Наблюдать образование раствора роданида железа кроваво-красного цвета. 4. Составить уравнение реакции в молекулярном и ионном виде.
Опыт №5. Обр |
||||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 421; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.120.64 (0.015 с.) |