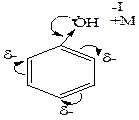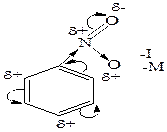Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Механизм реакции электрофильного замещенияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Механизм реакций электрофильного замещения в ароматическом кольце включает ряд последовательных стадий. 1) Образование электрофильной частицы. Как правило электрофильные частицы образуются в процессе реакции в присутствии катализаторов и соответствующих условиях. Например, при нагревании азотной кислоты образуется нитроний катион (а), серной кислоты - сульфоний катион (б), а при галогенировании (например, хлорирование) образуется электрофильная частица, которая может быть представлена катионом галогена или в виде комплекса галогена с катализатором (в):
а) б)
нитроний сульфоний катион катион в)
хлор комплекс катион с катализатором
2) Образование p - комплекса происходит при атаке p - электронного облака кольца электрофильной частицей, например, комплексом хлора с катализатором, при этом образуется p - комплекс по донорно – акцепторному типу. 3) Образование s - комплекса происходит при возникновении ковалентной связи между электрофилом и атомом углерода бензольного кольца, за счет пары электронов p -системы кольца, что сопровождается переходом атома углерода из sp 2 - в sp 3 - гибридизованное состояние. 4) Образование конечного продукта осуществляется за счет отщепления протона водорода от s - комплекса с помощью основания. Схема механизма реакции электрофильного замещения в бензоле на примере реакции хлорирования
Электрофильное замещение в бензоле приводит к образованию единственного продукта монозамещения, что определяется равномерным распределением электронной плотности в сопряженной системе кольца и, соответственно, равновероятной атакой электрофилом любого из шести атомов углерода бензола.
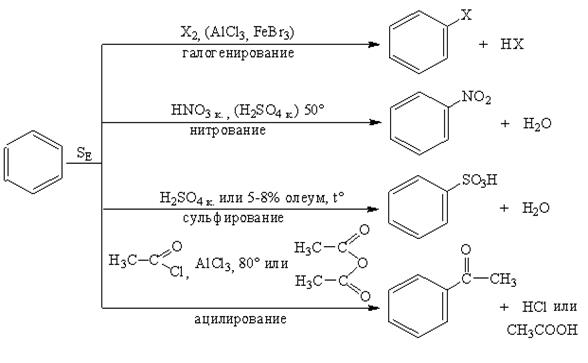
Реакции замещения Электрофильное замещение в бензоле представлено схемами синтеза гомологов бензола (а) и его производных (б). а) Синтез гомологов бензола:
б) Синтез производных бензола:
Галогенирование. Бензол в обычных условиях не взаимодействует с хлором и бромом. Реакция протекает только в присутствии катализаторов, которыми чаще всего являются галогениды алюминия, железа (кислоты Льюиса). Нитрование. Бензол нитруется смесью концентрированных азотной и серной кислот (нитрующая смесь) при нагревании до 60оС с образованием нитробензола.
Сульфирование. При взаимодействии бензола с концентрированной кислотой или олеумом (смесь концентрированной серной кислоты и серного ангидрида – SO3) образуется бензолсульфоновая кислота. Ацилирование представляет собой один из методов синтеза ароматических кетонов. В качестве ацилирующих реагентов используют хлорангидриды кислот (RCOCI) или ангидриды кислот (RCO-O-OCR). Реакцию проводят в неполярном растворителе в присутствии хлорида алюминия. Алкилирование является одним из способов получения гомологов бензола. В качестве алкилирующих реагентов можно использовать галогеналканы, спирты и алкены в присутствии галогенидов металлов (алюминия, железа, олова и др.). Правила ориентации в реакциях электрофильного Замещения в бензоле В производных бензола и его гомологов заместители нарушают равномерное распределение электронной плотности и тем самым, определенным образом, влияют на реакционную способность и направление атаки в бензольном кольце. Ориентирующее влияние заместителей, обусловленое суммарным действием их электронных эффектов (см. 2.5; табл.2.2), рассмотрим на примере фенола и нитробензола. В молекуле фенола заместитель (- ОН) проявляет отрицательнй индуктивный (- I) и положительный мезомерный (+ M) электронные эффекты, последний является преобладающим в суммарном электронодонорном (ЭД) действии (а). Электронный эффект ЭД заместителя приводит к перераспределению электронной плотности в кольце повышая ее в орто - и пара – положениях, в которых облегчается атака электрофильными реагентами. В молекуле нитробензола заместитель (-NO2) проявляет отрицательнй индуктивный (- I) и отрицательный мезомерный (+ M) электронные эффекты, что проявляется в суммарном электроноакцепторном (ЭА) действии (б). Электронный эффект ЭА заместителя приводит к перераспределению электронной плотности в кольце, понижая ее в орто - и пара – положениях, в которых затрудняется атака электрофильными реагентами.
а) б)
фенол нитробензол Правила замещения: 1) Электронодонорные заместители (ЭД) повышают электронную плотность кольца и тем самым увеличивают скорость реакции электрофильного замещения. К заместителям, проявляющим ЭД характер, относятся группы: - NH2, - OH, - OR, - R, которые ориентируют электрофильное замещение в орто - и пара - положение. Исключение составляют галогены, которые направляют электрофильную частицу предпочтительно в пара - положение.
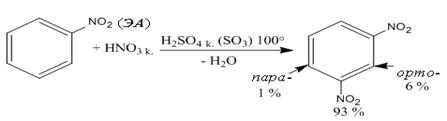
2) Электроноакцепторные заместители (ЭА) понижают электронную плотность кольца и тем самым уменьшают скорость реакции электрофильного замещения. К заместителям, проявляющим ЭА характер, относятся группы: - NO2, - COOH, - SO3H, >C=O и др., которые ориентируют электрофильное замещение в мета - положение, затрудняя его. Правила замещения можно продемонстрировать на реакции нитрования бензола (а) и его производных, содержащих электронодонорный (б) и электроноакцепторный (в) заместители. В представленных схемах реакций отражены условия и выход продукта реакции (в %), отражающий активность ориентирующего влияния заместителя в орто -, мета - или пара – положения. Как правило, в уравнении реакции указывают то направление электрофильной атаки, которое более предпочтительно в данных условиях реакции:
а) нитрование бензола:
нитробензол
б) нитрование фенола:
орто -нитро- пара -нитро- пикриновая фенол фенол кислота
в) нитрование нитробензола:
мета -динитробензол
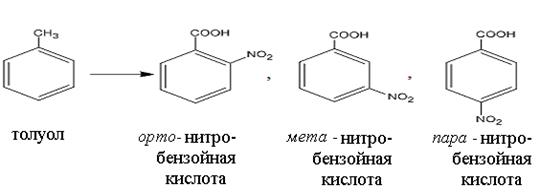
Электронные эффекты заместителей позволяют расположить приведенные соединения в следующий ряд по снижению активности в реакции нитрования: фенол, бензол и нитробензол. Если в бензольном кольце заместителей больше, чем один, то их ориентирующее влияние может быть согласованным или несогласованным, в зависимости от их типа и взаимного расположения. Примером согласованной ориентации может служить реакция нитрования орто - нитрофенола и пара - нитрофенола до пикриновой кислоты (реакция б). В данном случае оба заместителя (электронодонорный – ОН, электроноакцепторный – NO2) согласованно ориентируют последующее электрофильное замещение в орто - и пара - положения по отношению к гидроксильной группе. Ориентирующее влияние ЭД заместителя является определяющим в реакции электрофильного замещения, в случае его несогласованного ориентирующего действия с ЭА заместителем. Правила ориентирующего влияния заместителей используют для целенаправленного синтеза, включающего несколько последовательных реакций. Например, чтобы получить из толуола орто -, мета - и пара - нитробензойные кислоты необходимо в определенной последовательности провести реакции нитрования и окисления.
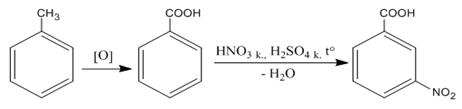
Метильная группа (- СН3) относится к электронодонорным заместителям, соответственно по правилам ориентирующего влияния направляет электрофильное замещение в орто - и пара - положения (а). Карбоксильная группа (- СООН) является электроноакцепторным заместителем, соответственно по правилам ориентирующего влияния направляет электрофильное замещение в мета - положение (б). Таким образом, чтобы получить из толуола все изомеры нитробензойной кислоты необходимо провести синтез в соответствии со схемами реакций, представленными ниже. а) Схема синтеза орто - и пара - изомеров нитробензойной кислоты предполагает первоначально провести реакцию нитрования, а затем – окисления:
б) Схема синтеза мета – изомера нитробензойной кислоты предполагает первоначально провести реакцию окисления, а затем – нитрования:
|
|||||||
|
Последнее изменение этой страницы: 2016-06-28; просмотров: 4572; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.241.174 (0.008 с.) |


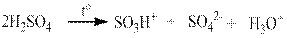
 или
или