Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ароматические углеводороды (арены)Содержание книги
Поиск на нашем сайте
Электродегидраторы применяются для глубокого обезвоживания и обессоливания нефти.
Под воздействием электрического поля происходит упорядочение движения, а затем столкновение капель воды. Если расстояние между каплями незначительное, а размеры этих капель относительно велики, то сила притяжения становится настолько большой, что бронированные эмульгаторами оболочки этих капель сдавливаются и разрушаются. В результате происходит укрупнение и слияние капель воды и их осаждение.
Свойство капель воды в эмульсиях располагаться вдоль силовых линий электрического поля и было использовано для разрушения эмульсий типа В/Н в аппаратах, называемых электродегидраторами. Эффективность разрушения эмульсий в поле переменного тока значительно выше, чем в поле постоянного тока. В поле переменного тока происходит циклическое изменение направления движения тока и напряженности поля, в результате чего капли воды изменяют направление своего движения синхронно основному полю и поэтому все время находятся в состоянии колебания.
Под воздействием сил переменного электрического поля форма капель постоянно меняется, в связи с чем капли воды испытывают непрерывную деформацию, что способствует разрушению адсорбированных на каплях воды оболочек и их слиянию. В электродегидраторах используется переменный ток промышленной частоты (50 герц) В электрическом поле электродегидраторов происходит не только разделение эмульсии на нефть и воду, но и отделение солей, содержащихся в этих водах. Последнее связано с проявлением гальванического процесса в электрическом поле напряженности электродегидраторов. В целом электродегидраторы из-за наличия двойного эффекта получили распространение как электрообезвоживаю- щие и электрообессоливающие установки и имеют другое распространенное название ЭЛОУ. Опыт работы показал, что наиболее эффективными и экономичными являются горизонтальные электродегидраторы. Нагретая нефтяная эмульсия, содержащая деэмульгатор и до 5—10% пресной воды, поступает через два распределителя эмульсии 6, изготовленных из перфорированных труб,под слой отделившейся воды и поднимается вверх. В корпус вмонтированы два электрода 1 в форме решетчатых прямоугольных рам, подвешенных через подвесные проходные
изоляторы параллельно друг другу и занимающих почти все горизонтальное сечение аппарата. Расстояние между электродами может изменяться от 20 до 40 см. После перехода через границу раздела вода-нефть нефтяная эмульсия попадает сначала в зону электрического поля низкой напряженности, образующуюся между нижним электродом и поверхностью отделившейся воды, а затем в зону высокой напряженности между верхним и нижним электродами (Напряжение между электродами может составлять 11,33 и 44 кВ.). Под действием электрического поля капли воды, содержащиеся в нефти, поляризуются, взаимно притягиваются друг к другу, коалесцируют и осаждаются. Обезвоженная и обессоленная нефть выводится сверху аппарата через сборник нефти 2, а отделившаяся вода — снизу.
1 - электроды; 2 - сборник нефти; 3 - подвесные изоляторы; 4 – реактивная катушка; 5 - трансформатор; 6 - распределитель эмульсии;
Циклоалканы Простейшими представителями являются моноциклические углеводороды, общая формула которых СnН2n. Циклоалканы в зависимости от числа атомов углерода в цикле подразделяют на малые циклы (С3 и С4), средние (С5 –С7) и большие циклы (С8 и больше). Структуру циклоалканов представляют в виде многоугольников, в которых атомы углерода и водорода обычно не изображают. Изомерия и номенклатура. Структурная изомерия циклоалканов возможна по нескольким признакам: размеру цикла, размеру и числу заместителей в цикле, взаимному положению заместителей. Пропан не имеет изомеров, циклобутан имеет два изомера, циклопентан – пять, ниже представлены структурные изомеры состава С6Н12, в соответствии с признаками изомерии: а) по размеру цикла:
циклогексан метилцикло- этилциклобутан пропилцикло пентан пропан
б) по размеру и числу заместителей:
1,2,3-триметил- 1-метил-2-этил- 1-метил-2-этил- изопропил- циклопропан циклопропан циклопропан циклопропан в) по взаимному расположению заместителей:
1,1-диметилбутан 1,2-диметилбутан 1,3-диметилбутан Физические свойства. При обычных условиях только циклопропан и циклобутан являются газообразными веществами.Циклоалканы обычно имеют более высокую температуру кипения и плавления по сравнению с аналогичными соединениями алканов, например: циклопропан (tкип.=-126,9оС; tпл.=-33оС) и пропан (tкип.=-187,1оС; tпл.=-42,2оС).
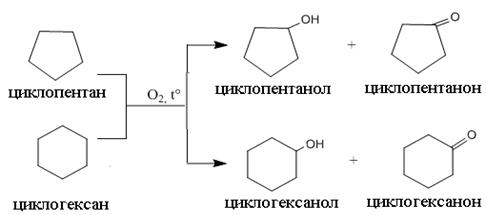
Химические свойства Реакционная способность циклоалканов в значительной степени зависит от устойчивости цикла. Реакции могут протекать по трем направлениям: замещения (SR); присоединения (AE или AR), которые сопровождаются раскрытием цикла; реакции изомеризации (сужение или расширение) циклов. Склонность к типу реакции определяется прочностью цикла: С3 – С4 склонны к реакциям присоединения, С5 – С6 склонны к реакциям замещения. Циклопентан и циклогексан по своим химическим свойствам наиболее близки с алканами. Они подвергаются радикальному галогенированию, нитрованию, сульфохлорированию, устойчивы к действию окислителей. Гидрогалогенирование характерно только для циклопропана при действии галогеноводородов в водном растворе, реакция протекает с разрывом цикла и образованием 1-иодпропана:
Галогенирование циклопропа и его гомологов может протекать как с разрывом цикла, так и с сохранением его по типу замещения. Бромирование на свету приводит к образованию 1,3-дибромпропана, как хлорирование при температуре больше 100оС. В тоже время при меньшей температуре реакция хлорирования протекает по типу замещения:
Циклоалканы состава С4 – С6 галогенируются по типу радикального замещения, например хлорирование по схеме:
Гидрирование циклоалканов с увеличением размера цикла протекает в более жестких условиях, с использованием температуры и катализатора:
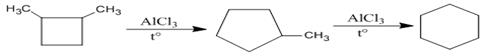
Изомеризация циклов характерна для гомологов и их производных, например, галогенопроизводных, спиртов, аминов. В зависимости от структуры субстрата во время реакции происходит изменение размера цикла в сторону увеличения (а, б) или уменьшения (в): а)
метилциклопентан циклогексан б)
1,2-диметилцикло- метилцикло- циклогексан бутан пентан в)
циклогептан метилциклогексан
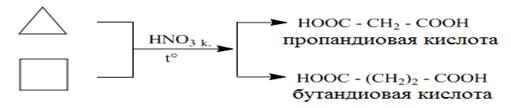
Окисление малых циклов С3 – С4 концентрированной азотной кислотой или кислородом (в присутствии катализатора) ведет к раскрытию цикла с образованием дикарбоновых кислот, при этом малые циклы устойчивы к действию раствора перманганата калия.
Лишь в жестких условиях циклопентан и циклогексан окисляются в соответствующие циклические спирты или кетоны (а), а если реакция идет с разрывом цикла - в дикарбоновые кислоты (б)
а)
б)
циклопентан пентандиовая кислота
Исторически неорганическая теория возникла раньше органической. До середины XIX в. нефть использовалась там, где имелись её выходы на поверхности – в Средиземноморье, в Калифорнии, Венесуэле и др. Ряд ученых того времени, например немецкий естествоиспытатель А.Гумбольдт, связал образование нефти и асфальта с вулканами. Во второй половине XIX в. химикам удалось в лабораторных условиях синтезировать ацетилен С2Н2, углеводороды метанового ряда. Знаменитый химик Д.И.Менделеев создал свою известную «карбидную» теорию происхождения нефти и выступил на заседании Русского химического общества в 1877 г., причем его гипотеза была обоснована на большом фактическом материале и сразу же завоевала популярность. Менделеев указал, что открытые к тому времени месторождения нефти сконцентрированы в окраинах горно-складчатых сооружений, линейно вытянуты, тяготеют к зонам крупных разломов. Через эти разломы вода проникает вглубь Земли, вступает в реакцию с углеродистыми металлами – с карбидами металлов, в результате чего возникает нефть, которая поднимается вверх, образует залежи:
2FeC+3H2O=Fe2O3+C2H6 Этот процесс, по Менделееву, происходил не только в прошлые геологические периоды, но и происходит сейчас. Карбидную теорию критиковал академик И.М.Губкин. Для карбидного варианта происхождения нефти необходимо существование проводящих путей воды к жидким карбидам и обратно, из очагов генерации к местам скопления нефти и газа. Губкин показал невозможность существования подобных трещин – проводящих путей от ядра Земли к верхней твердой оболочке. Препятствием является, по Губкину, пластичный базальтовый пояс, затрудняющий как проникновение воды вниз, так и обратный восходящий поток нефти и газа. Кроме того, в качестве аргумента против карбидной теории Губкин ссылался на тот факт, что образованные неорганическим путем нефти оптически неактивны, в то время как природная нефть оптически активна, способна вращать плоскость поляризации светового луча. Кроме карбидной известна космическая теория происхождения нефти. Автор этой теории русский геолог Н.А.Соколов выдвинул её в 1892 г. Он считал, что углеводороды изначально существовали в первозданном веществе Земли или образовались на ранних высокотемпературных стадиях её образования. С охлаждением Земли нефть поглощалась и растворялась в жидкой расплавленной магме. Впоследствии, когда возникла земная кора, из магмы выделились углеводороды, которые по трещинам в земной коре поднимались в верхние части, сгущались и там образовали скопления. Н.А.Соколов в качестве аргумента своей теории принял факты обнаружения углеводородов в метеоритах. Академик Губкин, критикуя эту теорию, написал, что она основана лишь на теоретических рассуждениях и не подтверждается геологическими наблюдениями. Губкин считал, что в природе в очень небольших количествах можно допускать образование нефти неорганическим путем, но это не имеет практического значения, основная масса скоплений нефти имеет все-таки органическое происхождение.
Органическая гипотеза
Химические свойства Арены относятся к высоко ненасыщенным соединениям, однако для них не характерны реакции электрофильного присоединения, свойственные алкенам и алкинам: бензол не обесцвечивает бромную воду и раствор перманганата калия.
Устойчивость аренов объясняется наличием высокой энергии сопряжения ароматической системы бензольного кольца. Для молекулы бензола энергия сопряжения равна 150 кДж/моль, нафталина - 250 кДж/моль, арнтрацена - 359 кДж/моль. В указанном ряду энергия сопряжения уменьшается (в расчете на одно бензольное кольцо), следовательно, уменьшается устойчивость молекулы и повышается его химическая активность. Арены предпочтительно вступают в реакции электрофильного замещения, в результате которого сохраняется ароматичность бензольного кольца. Реакции галогенирования, нитрования, сульфирования возможны со всеми аренами при действии различных электрофильных реагентов. Реакции алкилирования, ацилирования осуществляются только с соединениями, не содержащими электроноакцепторные заместители в кольце.
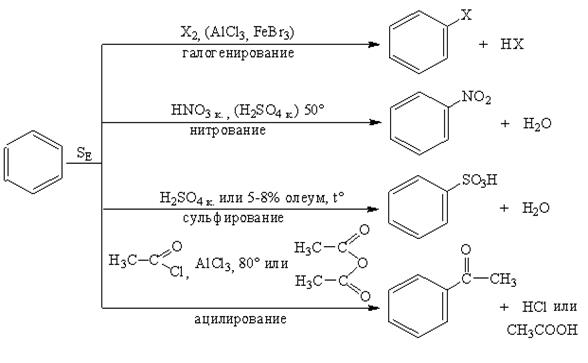
Реакции замещения Электрофильное замещение в бензоле представлено схемами синтеза гомологов бензола (а) и его производных (б). а) Синтез гомологов бензола:
б) Синтез производных бензола:
Галогенирование. Бензол в обычных условиях не взаимодействует с хлором и бромом. Реакция протекает только в присутствии катализаторов, которыми чаще всего являются галогениды алюминия, железа (кислоты Льюиса). Нитрование. Бензол нитруется смесью концентрированных азотной и серной кислот (нитрующая смесь) при нагревании до 60оС с образованием нитробензола. Сульфирование. При взаимодействии бензола с концентрированной кислотой или олеумом (смесь концентрированной серной кислоты и серного ангидрида – SO3) образуется бензолсульфоновая кислота. Ацилирование представляет собой один из методов синтеза ароматических кетонов. В качестве ацилирующих реагентов используют хлорангидриды кислот (RCOCI) или ангидриды кислот (RCO-O-OCR). Реакцию проводят в неполярном растворителе в присутствии хлорида алюминия. Алкилирование является одним из способов получения гомологов бензола. В качестве алкилирующих реагентов можно использовать галогеналканы, спирты и алкены в присутствии галогенидов металлов (алюминия, железа, олова и др.). Замещения в бензоле В производных бензола и его гомологов заместители нарушают равномерное распределение электронной плотности и тем самым, определенным образом, влияют на реакционную способность и направление атаки в бензольном кольце. Ориентирующее влияние заместителей, обусловленое суммарным действием их электронных эффектов (см. 2.5; табл.2.2), рассмотрим на примере фенола и нитробензола. В молекуле фенола заместитель (- ОН) проявляет отрицательнй индуктивный (- I) и положительный мезомерный (+ M) электронные эффекты, последний является преобладающим в суммарном электронодонорном (ЭД) действии (а). Электронный эффект ЭД заместителя приводит к перераспределению электронной плотности в кольце повышая ее в орто - и пара – положениях, в которых облегчается атака электрофильными реагентами. В молекуле нитробензола заместитель (-NO2) проявляет отрицательнй индуктивный (- I) и отрицательный мезомерный (+ M) электронные эффекты, что проявляется в суммарном электроноакцепторном (ЭА) действии (б). Электронный эффект ЭА заместителя приводит к перераспределению электронной плотности в кольце, понижая ее в орто - и пара – положениях, в которых затрудняется атака электрофильными реагентами.
а) б)
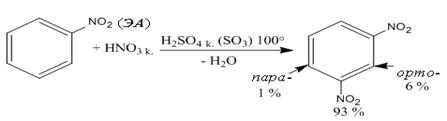
фенол нитробензол Правила замещения: 1) Электронодонорные заместители (ЭД) повышают электронную плотность кольца и тем самым увеличивают скорость реакции электрофильного замещения. К заместителям, проявляющим ЭД характер, относятся группы: - NH2, - OH, - OR, - R, которые ориентируют электрофильное замещение в орто - и пара - положение. Исключение составляют галогены, которые направляют электрофильную частицу предпочтительно в пара - положение. 2) Электроноакцепторные заместители (ЭА) понижают электронную плотность кольца и тем самым уменьшают скорость реакции электрофильного замещения. К заместителям, проявляющим ЭА характер, относятся группы: - NO2, - COOH, - SO3H, >C=O и др., которые ориентируют электрофильное замещение в мета - положение, затрудняя его. Правила замещения можно продемонстрировать на реакции нитрования бензола (а) и его производных, содержащих электронодонорный (б) и электроноакцепторный (в) заместители. В представленных схемах реакций отражены условия и выход продукта реакции (в %), отражающий активность ориентирующего влияния заместителя в орто -, мета - или пара – положения. Как правило, в уравнении реакции указывают то направление электрофильной атаки, которое более предпочтительно в данных условиях реакции:
а) нитрование бензола:
нитробензол
б) нитрование фенола:
орто -нитро- пара -нитро- пикриновая фенол фенол кислота
в) нитрование нитробензола:
мета -динитробензол
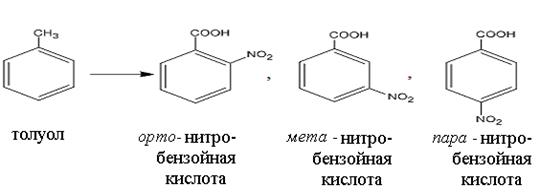
Электронные эффекты заместителей позволяют расположить приведенные соединения в следующий ряд по снижению активности в реакции нитрования: фенол, бензол и нитробензол. Если в бензольном кольце заместителей больше, чем один, то их ориентирующее влияние может быть согласованным или несогласованным, в зависимости от их типа и взаимного расположения. Примером согласованной ориентации может служить реакция нитрования орто - нитрофенола и пара - нитрофенола до пикриновой кислоты (реакция б). В данном случае оба заместителя (электронодонорный – ОН, электроноакцепторный – NO2) согласованно ориентируют последующее электрофильное замещение в орто - и пара - положения по отношению к гидроксильной группе. Ориентирующее влияние ЭД заместителя является определяющим в реакции электрофильного замещения, в случае его несогласованного ориентирующего действия с ЭА заместителем. Правила ориентирующего влияния заместителей используют для целенаправленного синтеза, включающего несколько последовательных реакций. Например, чтобы получить из толуола орто -, мета - и пара - нитробензойные кислоты необходимо в определенной последовательности провести реакции нитрования и окисления.
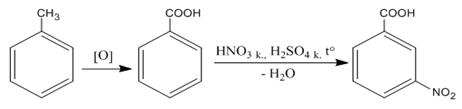
Метильная группа (- СН3) относится к электронодонорным заместителям, соответственно по правилам ориентирующего влияния направляет электрофильное замещение в орто - и пара - положения (а). Карбоксильная группа (- СООН) является электроноакцепторным заместителем, соответственно по правилам ориентирующего влияния направляет электрофильное замещение в мета - положение (б). Таким образом, чтобы получить из толуола все изомеры нитробензойной кислоты необходимо провести синтез в соответствии со схемами реакций, представленными ниже. а) Схема синтеза орто - и пара - изомеров нитробензойной кислоты предполагает первоначально провести реакцию нитрования, а затем – окисления:
б) Схема синтеза мета – изомера нитробензойной кислоты предполагает первоначально провести реакцию окисления, а затем – нитрования:
Конденсированных аренов Реакции электрофильного замещения в нафталине протекают в более мягких условиях, предпочтительно по 1 – положению (или α-), повышение температуры реакции приводит к образованию продукта замещения водорода во 2 – положение (или b-). Галогенирование нафталина осуществляется в присутствии галогенидов металлов при температуре 20-40оС.
1-бромнафталин 2-бромнафталин (99%) (1%)
б) Нафталин нитруется азотной кислотой в уксусном ангидриде при слабом нагревании или нитрующей смесью при комнатной температуре, повышение температуре способствует образованию более устойчивого b - продукта.
1-нитронафталин 2-нитронафталин
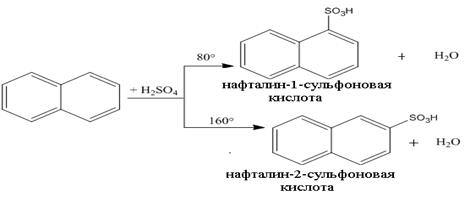
в) Сульфирование нафталина является примером термодинамически контролируемой реакции. Действие безводной концентрированной серной кислоты при 80оС приводит к образованию нафталин-1-сульфоновой кислоты, а повышение температуры до 160оС – нафталин-2-сульфоновая кислота:
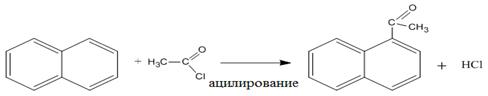
г) Ацилирование нафталина хлористым ацетилом при 0оС приводит к образованию предпочтительно 1- ацетилнафталина, выше 30оС – 2- ацетилнафталина:
Реакции присоединения для нафталина протекают в более мягких условиях в сравнении с бензолом. Например, гидрирование по одному бензольному кольцу возможно при действии водорода в момент выделения, в условиях каталитического гидрирования нафталин превращается в насыщенный декагидронафталин (тетралин).
тетралин декалин
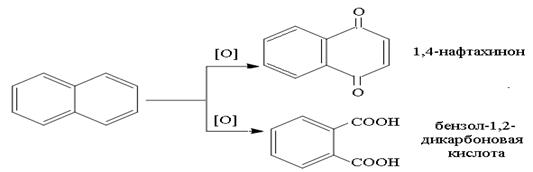
Окисление нафталина протекает легче, чем бензола. В более мягких условиях окисления образуется нафтахинон-1,4, при действии сильного окислителя – происходит разрушение одного из колец с образованием дикарбоновой кислоты по схеме:
Отдельные представители Бензол ( С6Н6) - жидкость с характерным запахом, почти нерастворимая в воде. Получают бензол при сухой перегонке каменного угля и переработки нефти. Широко используется в промышленности в качестве растворителя и сырья для синтеза красителей, полимеров, взрывчатых веществ, поверхностно - активных веществ. Бензол токсичен, вдыхание паров вызывает острое отравление, приступы головокружения, судороги. В организме углеводороды подвергаются С - гидроксилированию (окисление с ообразованием гидроксисоединений) и выводятся из клетки. Однако бензол окисляется очень медленно, поэтому накапливается в организме и относится к кумулятивным ядам. Толуол (метилбензол) - бесцветная жидкость, нерастворимая в воде. Применяют для получения бензола, бензойной кислоты, сахарина, взрывчатых веществ, лаков. Толуол добавляют к моторному топливу как высокооктановый компонент бензинов. Толуол примерно на два порядка мене токсичен, чем бензол, так как окисляется в организме до бензойной кислоты и быстрее выводится из клетки. Кумол (изопропилбензол) - жидкость, является важным продуктом для синтеза фенола и ацетона кумольным способом. Цимол (пара -метилизопропилбензол) - является основой многих эфирных масел. Стирол (винилбензол) - приятно пахнущая жидкость, исходный мономер для получения полимеров, например, полистирола, который применяют в качестве электроизоляционного материала. При сополимеризации с бутадиеном получают некоторые виды синтетических каучуков. Полистирольные полимеры, содержащие функциональные группы кислого или основного характера, используют в качестве ионообменных смол. Ксилолы (диметилбензолы) используют в качестве компонента высокооктановых бензинов и растворителей в лакокрасочной промышленности, а так же применяют для получения полиэфиров. Нафталин - бесцветные пластинки, обладающие высокой летучестью (возгонка) и характерным запахом. Используется для получения фталевого ангидрида, фталевой кислоты, растворителей (тетралин и декалин) и разнообразных других производных. Антрацен - твердое вещество, в виде антрахинона используется в синтезе антрахиноновых красителей. Фенантрен в частично или полностью гидрированном состоянии входит в состав стероидных гормонов, алкалоидов как основной структурный компонент.
Сернистые соединения нефти
Сера является наиболее распространенным гетероэлементом в нефти и нефтепродуктах. Содержание ее в нефтях месторождений России изменяется от 0,05% до 3%. Таблица 26 Содержание серы в нефтях некоторых месторождений
В соответствии с технологической классификацией в зависимости от содержания серы нефти подразделяются на три класса: I- малосернистые, содержание до 0,5% серы; II- сернистые, содержание до 0,51 -2,0% серы; III- высокосернистые, содержащие более 2,0% серы. С повышением температуры кипения нефтяных фракций содержание в них серы увеличивается. До 60% всей серы нефти содержится во фракциях топлив и масел (выкипающих до 4500С), 40% и более в мазуте. Распределение серы по фракциям иллюстрируется данными таблицы 27. Таблица 27
Распределение серы (в масс. %) по фракциям различных сернистых и высокосернистых нефтей
Распределение серы по фракциям зависти от природы сернистых соединений.
Характеристика сернистых соединений нефти Сера в нефти и нефтепродуктах может содержаться в виде неорганических соединений серы: элементная сера и сероводород и органических: меркаптаны, сульфиды, дисульфиды, тиофены, тиофаны. Значительная часть серы нефти входит в состав смолисто-асфальтеновых веществ, это не идентифицированная сера. Элементная сера и сероводород в сырых нефтях содержатся в незначительных количествах или не содержатся совсем. Они появляются в нефтях или в нефтяных фракциях в результате вторичных реакций. Сера может получаться при окислении сероводорода кислородом воздуха.
Или при термическом разложении дисульфидов
В свою очередь, дисульфиды образуются при окислении меркаптанов
Сероводород обычно образуется в процессах переработки нефти в результате термического разложения меркаптанов и сульфидов или при реакции углеводородов с серой.
Б.Н.Айвазовым как критерий термической стабильности сернистых соединений было предложении сероводородное число – количество Н2S(в мг), выделяющегося при нагревании 100 г нефти при 3000С в течение часа. Сероводородное число не связано с общим содержанием серы, так как, оно изменялось от 4,2 до 300,6 при изменении содержания серы от 0,7 до 30,3%. Оно связано с термической стабильностью сернистых соединений, что важно в процессах переработки нефти. Качественно сера и сероводород обнаруживаются по реакции
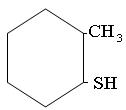
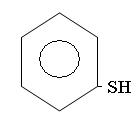
Меркаптаны RSH, или тиоспирты,или тиолы. Называюся про радикалу с добавлением слова меркаптан или тиол. Радикалы могут быть любые: алифатические, нафтеновые, ароматические:
изопропилмеркаптан
2-метил-циклогексилмеркаптан
фенилмеркаптан или тиофен
В виде меркаптанов сравнительно немного серы нефти – от 1 до 15% от всей серы нефти.Однако известны исключения из этой закономерности. Так нефть Марковского месторождения (Иркутская область) при общем содержании серы 0,96% содержит 0,77% меркаптановой серы; фракция 40-2000С газоконденсата Оренбургского месторождения содержит 1,24% общей серы, в том числе 0,297% меркаптановой. В наибольшем количестве меркаптаны содержатся в бензиновой фракции, с повышением температуры кипения их содержание быстро уменьшается; это связано с их низкой термической стабильностью. До 3000С меркаптаны разлагаются с образованием сульфидов.
При более высоких температурах - до олефинов
Сероводород может вновь присоединиться к олефину
Интересной особенностью алкилтиолов бензиновых фракций является то, что SH- группа чаще находится при вторичном или третичном атоме углерода, чем при первичном, что свидетельствует об их вторичном происхождении. По увеличении термической стабильности меркаптаны располагаются в ряд: первичные, вторичные, третичные, ароматические. Слабыми окислителями (кислород воздуха, иод)меркаптаны окисляются до дисульфидов.
Сильными окислителями (азотная кислота, гидроперекиси(образующиеся при окислении углеводородов)) - до сульфокислот и даже до серной кислоты.
Образованием кислот, более агрессивных, чем меркаптаны, объясняется высокая коррозионная активность меркаптанов. С другой стороны, разрушая гидроперекиси, меркаптаны тормозят окисление углеводородов. Будучи, и обладая кислотными свойствами, меркаптаны взаимодействуют со щелочами, оксидами и солями металлов.
Промывка бензинов водно-щелочным раствором едкого натра (спирт добавляется для снижения гидролиза меркаптида натрия) используется для демеркаптанизации бензинов. Реакция с PbO является качественной реакцией на меркаптаны(докторская проба), после удаления Н2S.
Образование черного осадка PbS свидетельствует о наличии меркаптанов. Реакция с AgNO3 используется для количественного определения меркаптанов (титрованием) после удаления сероводорода. Соли образованные меркаптанами, называютмя меркаптидами с добавлением названия радикала (метилмеркаптид калия, бутилмеркаптид свинца) и т.д. В настоящее время выделено более 50 различных меркаптанов с числом углеродных атомов от 1 до9; из них более 40 алкилтиолов, 6 циклоалкилтиолов и тиофенол. Все меркаптаны имеют неприятный запах,низшие используются для одорации природного газа. Сульфиды или тиоэфиры подразделяются на алифатические (диалкилсульфиды) и алициклические (тиацикланы), содержащие атом серы в цикле. Алифатические называются по названию радикалов:
Метилфенилсульфид
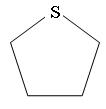
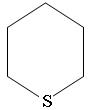
Циклические сульфиды называются как углеводороды с тем же числом углеродных атомов, включая серу, с добавлением приставки тиа:
Тиациклопентан
Тиациклогексан Или по количеству метиленовых групп –СН2, связанных через атом серы: тетраметиленсульфид, пентаметиленсульфид Сульфида содержатся в бензиновых и в основном в средних фракциях нефти, где они могут составлять более половины всех сернистых соединений. В бензиновых фракциях содержатся в основном диалкилсульфиды, в керосино-газойлевых и масляных фракциях – в основном циклические сульфиды. Таблица 28 Групповой состав сульфидов различных нефтей
Количество диалкилсульфидов (тиацикланов) снижается с повышением температуры кипения фракции; выше 3000С они практически отсутствуют. Углеводородные радикалы, содержащие три и более атомов углерода, обычно связаны с серой по вторичному углеродному атому.
Выделено более 50 тиаалканов, в т.ч. все изомеры С2-С6.Алкилциклоакилсульфиды и алкиларилсульфиды изучены в меньшей степени. В тиацикланах цикл, содержащий атом серы, может входить в полициклическую систему,содержащую до семи колец. Атом серы чаще входит в пятичленный цикл (тиациклопентан) –на 60-70% и в 30-40
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-28; просмотров: 735; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.178.227 (0.016 с.) |















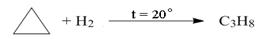

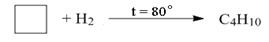
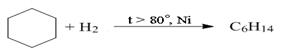







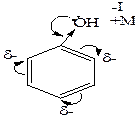
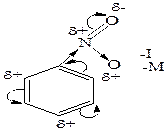







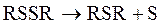
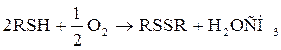
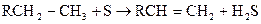




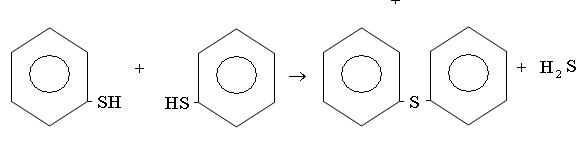

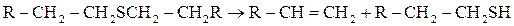







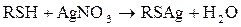

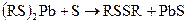
 диметилсульфид
диметилсульфид