Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теплота изотермического процесса равна работе процесса.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Закон Гей-Люссака–Джоуля: Внутренняя энергия идеального газа не зависит от давления и объема, а зависит только от температуры. АДИАБАТИЧЕСКИЙ ПРОЦЕСС (dQ = 0, Q = 0) Это процесс, протекающий без теплообмена между системой и окружающей средой. PdV + CV dT = 0
R R = CP - CV Þ (CP - CV) ( После интегрирования: ln Vg-1 + ln T = const ln TVg-1 = const TVg-1 = const¢ (1) T = PVg = const¢¢ (2) Уравнения (1) и (2) - уравнения адиабаты (уравнения Пуассона). Работа при адиабатическом процессе: dA + CV dT = 0, dA = - CV dT, A = - A > 0 при расширении Þ Т падает при адиабатическом расширении, т.е. работа адиабатического расширения совершается за счет уменьшения внутренней энергии. При адиабатическом сжатии U увеличивается, Т растет. A = CV (T1 - T2) = CV ( A =
ЭНТАЛЬПИЯ (Теплосодержание). Энтальпия Н - это сумма внутренней энергии (U) и внешней (PV): H = U + PV Если процесс идет при P = const: dQP = dU + PdV = dU + d (PV) = d (U + PV) = dH Тепло, передаваемое системе при P = const, расходуется на приращение энтальпии. DH = DU + PDV Изменение энтальпии в изобарном процессе включает в себя изменение внутренней и внешней энергии, причем изменение внешней энергии равно работе изобарного расширения (сжатия). U - функция состояния; Р и V - параметры состояния, их изменение не зависит от пути процесса. Следовательно, Н - также функция состояния, т.к. ее изменение не зависит от пути процесса. dQP = dH, QP = DH Теплота, поглощаемая при Р = const, также не зависит от пути процесса. Если процесс изобарно-изотермический, то DU = 0 и DH = PDV. СР = Введение энтальпии упрощает математическое выражение изобарного процесса. Кроме того, изменение Н может быть во многих случаях легко измерено, вследствие чего эта функция широко применяется при термодинамических исследованиях, особенно изобарных процессов. Абсолютное значение энтальпии не может быть вычислено с помощью уравнений термодинамики, т.к. оно включает в себя абсолютную величину внутренней энергии. Лекция 3 Термохимия. Закон Гесса. Стандартные теплоты образования и сгорания. Уравнения Кирхгоффа. При химических реакциях происходит изменение внутренней энергии системы, т.к. внутренняя энергия продуктов реакции отличается от внутренней энергии исходных веществ. Изучение изменений U при химических реакциях является одним из основных путей изучения энергии химических связей. Кроме того, изменения U при реакции (или теплота реакции) являются необходимыми исходными величинами для термодинамических расчетов химических реакций, имеющих большое практическое значение для химической технологии. Изменение U в процессе химического превращения вещества происходит, как и в др. случаях, путем поглощения (выделения) теплоты и совершения работы. Работа обычно мала; она может быть вычислена или ею можно пренебречь. Теплота реакции часто значительна; она может быть во многих случаях непосредственно измерена. Изучением теплот химических реакций занимается термохимия. Закон: Количество теплоты, необходимое для разложения соединения на его составные части, равно количеству теплоты, выделяющейся при образовании соединения из тех же составных частей. Изменение U при химической реакции, в соответствии с I законом термодинамики, не зависит от пути, по которому протекает реакция, а лишь от химической природы и состояния начальных и конечных веществ реакции. Теплота реакции в общем случае не является изменением функции состояния и зависит от пути процесса. Однако по крайней мере в двух простейших случаях теплота процесса не зависит от его пути: 1. Реакция протекает при V = const и не совершается электрическая и др. виды работы: QV = DU = U2 - U1 2. Реакция протекает при P = const и совершается только работа объемного расширения: QP = DH = H2 - H1 Закон независимости суммарной теплоты химической реакции от пути процесса был открыт в 1836 г. (еще до установления I ЗТ) русским ученым Гессом. Закон Гесса (закон постоянства сумм теплот реакций) -основной закон термохимии: если из данных исходных веществ можно получить заданные конечные продукты разными путями, то суммарная теплота процесса на каком-либо одном пути равна суммарной теплоте процесса на любом другом пути, т.е. не зависит от пути перехода от исходных веществ к продуктам реакции. Закон Гесса вытекает из I ЗТ при ограничивающих условиях: V = const или P = const. Схематически это можно показать следующим образом:
В термодинамике: Q > 0 - которое подводится к системе и ею поглощается, Q < 0 - которое система выделяет; в термохимии: Q > 0 - которое выделяется (экзотермическая реакция), Q < 0 - которое поглощается (эндотермическая реакция). QP, QV - термодинамические обозначения; QP = - В обоих случаях: А > 0, если производится системой; А < 0, если внешние силы совершают работу над системой. Расширение > 0, сжатие < 0. Соответственно, существуют две системы записи уравнений химической реакции с учетом теплового эффекта: 1. Термохимическое уравнение: С6Н6 (ж) + 7 Значки в скобках указывают на агрегатное состояние компонента; эти символы опускают, когда при условиях проведения реакции агрегатное состояние компонента реакции является вполне определенным. 2. В настоящее время более принята термодинамическая система записи теплот химических реакций: С6Н6 (ж) + 7 Если в реакции участвуют только твердые и жидкие вещества, то изменение объема DV незначительно и QP» QV. Если же в реакции участвуют газообразные вещества при небольших Р, то связанное с этим изменение объема при постоянных Р и Т значительно. PDV = P (V2 - V1) = PV2 - PV1 = n2RT - n1RT = DnRT QP = QV + DnRT, Здесь Dn - разность между числом молей газообразных продуктов реакции и газообразных исходных веществ. Значение закона Гесса заключается в том, что, пользуясь им, можно определить теплоты реакций, которые или не реализуются на практике, или не могут быть проведены чисто и до конца. Пример: 1. С + О2 = СО2 QP1 3. СО + 2. С + QP2 опытным путем определить невозможно, но можно найти с помощью закона Гесса: QP1 = QP2 + QP3, необходимо только сравнивать теплоты различных реакций в одних и тех же условиях. СТАНДАРТНЫЕ ТЕПЛОТЫ ОБРАЗОВАНИЯ И СГОРАНИЯ. Закон Гесса дает возможность рассчитать теплоты множества реакций по минимальному числу теплот некоторых реакций. Для этого используются стандартные теплоты. Стандартная теплота образования (DНо f , 298) - это тепловой эффект реакции образования 1 моля вещества из простых веществ, взятых в их обычном соотношении и при стандартных условиях: Р = 1 атм, Т = 298 К. Считают, что простые вещества реагируют в виде той модификации и в том агрегатном состоянии, которые отвечают наиболее устойчивому состоянию элементов при данных Р и Т. При этих условиях теплота образования принимается равной нулю (например, для О2, N2, S, C...). Соединения, для которых теплота образования DНо f , 298 положительна - эндотермические, для которых DНо f , 298 < 0 - экзотермические. Зная стандартные теплоты образования всех участников реакции, можно рассчитать тепловой эффект самой реакции. Следствие из закона Гесса: тепловой эффект химической реакции равен сумме стандартных теплот образования продуктов реакции за вычетом суммы стандартных теплот образования исходных веществ. а A + b B = c C + d D (DНо298)x = c (DНо f , 298)C + d (DНо f , 298)D - a (DНо f , 298)A - b (DНо f , 298)B (DНо298)x = å n (DНо f , 298)конеч.в-в - å n (DНо f , 298)нач.в-в Стандартные теплоты образования табулированы. Стандартная теплота сгорания (DHoc, 298) - тепловой эффект реакции взаимодействия 1 моля вещества с кислородом с образованием при этом продуктов полного окисления при стандартных условиях (Р = const, Т = 298 К). Тепловой эффект реакции можно рассчитать по теплотам сгорания исходных и конечных веществ: (DНо298)x = å n (DНoc, 298)нач.в-в - å n (DНoc, 298)конеч.в-в Теплоты сгорания часто используются для нахождения теплот реакций органических соединений, которые почти никогда не протекают однозначно и до конца. Это объясняется двумя причинами: 1) горение в кислороде является реакцией, общей для всех органических веществ и идущей при соблюдении некоторых условий до конца, т.е. полностью и однозначно; 2) техника сожжения органических веществ при V = const достигла высокого совершенства и позволяет определить теплоту сгорания с точностью до ± 0,02%. Комбинируя теплоты сгорания, можно вычислить теплоту любой химической реакции между органическими веществами. Примеры: 1. Найдем теплоту реакции С6Н6 (ж) = 3С2Н2 DНоI =? (I) Теплоты сгорания известны: С6Н6 + 7 C2H2 + 2 (I) = (II) - 3 (III); DHoI = DHoII - 3DHoIII = 150880 кал 2. Найдем с помощью теплот сгорания теплоту образования органического вещества: (теплота образования кислорода равна нулю) С2Н2 + 2 DНoc, 298 = 2
Недостаток расчета теплот реакций по теплотам сгорания (большой, но неизбежный) - уменьшение относительной точности получаемых результатов по сравнению с точностью исходных данных: во-первых, идет сложение ошибок, допущенных при измерении теплот сгорания органических реагентов; во-вторых, теплота реакции между реагентами почти всегда много меньше теплот сгорания реагентов. Во многих случаях относительная ошибка получаемой величины равна нескольким процентам (до нескольких десятков процентов). ЗАВИСИМОСТЬ ТЕПЛОТЫ ПРОЦЕССА ОТ ТЕМПЕРАТУРЫ. (Уравнения Кирхгоффа) Рассмотренные выше теплоты химических реакций являются теплотами изотермических процессов и зависят от Т. QV = DU = U2 - U1; QP = DH = H2 - H1 Продифференцируем эти равенства по Т при V (P) = const:
CV,2 - мольная теплоемкость при V = const всей массы продуктов реакции CV,1 - всей массы исходных веществ
CV,2 - CV,1 = CP,2 - CP,1 = Уравнения Кирхгоффа дают зависимость теплоты химической реакции от Т. Дифференциальная форма записи уравнений:
Для расчетов теплот реакций уравнения должны быть проинтегрированы: (Если интервал температур небольшой - десятки градусов - то С от Т практически не зависит и Если Т изменяется в широком интервале, то С i ¹ const и для интегрирования надо знать зависимость С от Т. В широком интервале Т (не слишком низких - выше 200 К) зависимости С чистых веществ от Т могут быть выражены эмпирическими степенными рядами: СР = a + b T + c T2 +... (для оргaнических веществ) СР = a ¢ + b ¢T + c ¢T-2 (для неорганических веществ) СР = a ¢¢ + b ¢¢T + c ¢¢T-1/2 Интегральная форма записи уравнений Кирхгоффа: DНТ = DНо + Лекция 4
|
|||||||||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 1066; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.127.13 (0.012 с.) |

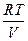 dV + CV dT = 0 /: T
dV + CV dT = 0 /: T + CV
+ CV 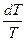 = 0
= 0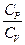 - 1)
- 1) 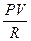 ,
, 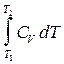 = CV (T1 - T2)
= CV (T1 - T2)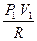 -
- 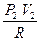 ) =
) = 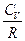 (P1V1 - P2V2)
(P1V1 - P2V2)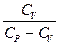 (P1V1 - P2V2) =
(P1V1 - P2V2) = 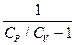 (P1V1 - P2V2) =
(P1V1 - P2V2) = 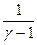 (P1V1 - P2V2)
(P1V1 - P2V2)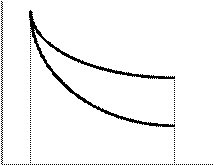 P
изотерма
адиабата
V1 V2 V
P
изотерма
адиабата
V1 V2 V
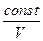 и P =
и P = 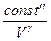 Адиабата идет круче, чем изотерма.
Адиабата идет круче, чем изотерма.
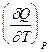 =
= 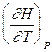 , dH = CP dT, DH = CP DT
, dH = CP dT, DH = CP DT
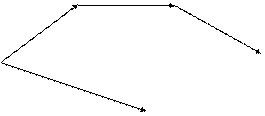 Q3
Q1
A B
Q4 Q5
E
Q3
Q1
A B
Q4 Q5
E
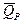 ,
, 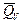 - термохимические.
- термохимические.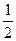 О2 = 6СО2 + 3Н2О (ж) + 780980 кал
О2 = 6СО2 + 3Н2О (ж) + 780980 кал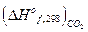 +
+ 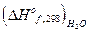 -
- 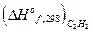
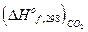 +
+ 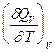 =
= 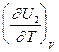 -
- 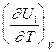 = CV,2 - CV,1 = DCV
= CV,2 - CV,1 = DCV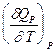 =
= 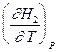 -
- 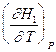 = CP,2 - CP,1 = DCР
= CP,2 - CP,1 = DCР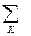 nкCV,к -
nкCV,к - 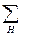 nнСV,н =
nнСV,н = 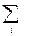 n i CV, i
n i CV, i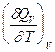 =
= 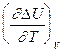 =
= 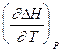 =
= 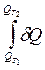 =
= 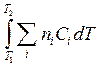
 ,
, 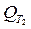 =
= 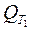 +
+ 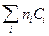 (Т2 - Т1)
(Т2 - Т1)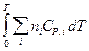 , DНТ = DН298 +
, DНТ = DН298 +