
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Если насыщенный пар можно считать идеальным газом, тогда ⇐ ПредыдущаяСтр 6 из 6
DНисп = Т Давление насыщенного пара жидкости можно сравнительно легко и точно измерить в широком интервале Т; значительно труднее измерить DНисп. По вышеприведенному уравнению можно рассчитать DНисп, причем интервал температур должен быть небольшим, т.к. величина DНисп изменяется с ростом Т. Более точно
DНисп различных жидкостей закономерно связаны с их нормальными температурами кипения: 1. Правило Трутона: DSисп = мольные энтропии испарения различных жидкостей в нормальных точках кипения одинаковы. 2. Уравнение Кистяковского (более точное): DSисп = 3. Правило Гильдебранда – аналогично правилу Трутона, но выполняется более точно: DSисп жидкостей равны между собой при температурах, для которых мольные объемы насыщенного пара одинаковы, при этом DSисп = 20 – 22 Эти правила не выполняются в отношении многих веществ, например, ассоциированных жидкостей (вода, аммиак, спирты), а приблизительно выполняются для углеводородов и их производных, эфиров и других классов неполярных веществ. ФАЗОВЫЕ ПЕРЕХОДЫ ВТОРОГО РОДА. Для них характерно не только равенство изобарных потенциалов, но и равенство энтропии и объемов сосуществующих в равновесии фаз, т.е. отсутствие теплового эффекта процесса и изменения объема при Т превращения: DG = DS = DV = 0 Но меняются скачкообразно некоторые другие параметры, например, СР. Примеры фазовых переходов второго рода: 1. Скачкообразное изменение СР при превращении двух модификаций жидкого гелия при 2,2 К.
2. Превращения ферромагнитных тел при Т, называемой точкой Кюри, выше которой тела теряют ферромагнитные свойства.
3. Превращения обычных металлов в сверхпроводники при низких Т. 4. Процессы распада и образования интерметаллидов в твердых металлических растворах. ЗАВИСИМОСТЬ ДАВЛЕНИЯ НАСЫЩЕННОГО ПАРА ОТ ТЕМПЕРАТУРЫ. Давление насыщенного пара жидкости резко увеличивается с ростом Т; эта зависимость дается уравнением: dP = а вдали от критической Т: d ln P = Если интервал температур небольшой и DНисп можно считать постоянной, то
Мы получили уравнение для расчета DНисп, зная Р2 при Т2 и Р1 при Т1. Представим в виде неопределенного интеграла: ln P = – Это – уравнение прямой в координатах ln P – 1/Т. DНисп можно найти по графику:
Такое уравнение может быть получено путем применения уравнения Кирхгоффа к процессу парообразования.
(Cнас. п. Можно заменить на СР при не очень высоких Р).
(DНо – теплота испарения при 0 К). Подставим вышеприведенное уравнение в уравнение: d ln P = ò d ln P = ò ln P = – j – постоянная интегрирования. DНо и j могут принимать различные значения в зависимости от точности используемых данных по СР. Если DСР известно точно и в широком интервале Т (что выполняется редко), то j определяется однозначно и называется истинной химической постоянной. DНТ = DНо + a T + b T2 + c T3 + … Подставим это выражение в то же самое уравнение: d ln P = ln P = – lg P = – (const¢ = const /2,303 – переход от ln к lg; такие числовые значения получаются, если R выражено в калориях). Это уравнение было приведено Нернстом; он его упростил: lg P = – i – условная химическая постоянная. Величины DНо, e и i подбираются эмпирически; это менее точное уравнение, чем уравнение, в которое входит j. Величина i для многих веществ с двух- и многоатомными молекулами» 3 (если Р – в атм).
Кривые давления насыщенного пара можно экстраполировать к высоким Р и Т методами сравнительного расчета. Эти методы основаны на подобии кривых, выражающих зависимость давления пара жидкостей от Т (особенно жидкостей, близких по химическим свойствам и Ткип). За стандартную выбирается одна из жидкостей (например, вода), давление пара которой хорошо изучено.
|
||||||||||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 406; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.142.115 (0.006 с.) |

 ,
,  =
= 

 » 20 – 22
» 20 – 22 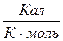 –
–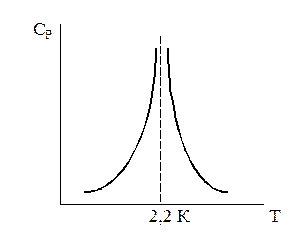
 dT,
dT, =
= 
 , ln
, ln  =
=  –
–  ) =
) = 
 + const =
+ const =  + B
+ B
 = Cнас. п. – Сж» DСР
= Cнас. п. – Сж» DСР =
=  , DНТ = DНо +
, DНТ = DНо +  dT + ò
dT + ò 
 +
+  ò
ò  + j
+ j dT +
dT +  dT +
dT +  dT + …
dT + … ln T +
ln T +  + … + const
+ … + const ×
×  +
+  lg T +
lg T +  T + … + const¢
T + … + const¢ T + i
T + i


