
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Термодинамика электрохимических процессовСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Совершение работы является решающим фактором в ходе химических реакций. Одним из немногих случаев, когда совершаемая работа может быть измерена, являются электрохимические процессы, в ходе которых происходит превращение химической энергии в электрическую и наоборот ХÛЭ. Прямой процесс превращения Х®Э происходит в гальванических элементах (в том числе аккумуляторах) в процессе электрон химической коррозии, обратный – при электролизе. Для изучения термодинамической зависимости между химической реакцией окисления–восстановления, протекающей в элементе, и вырабатываемой ею электрической энергией особый интерес представляют обратимые элементы, так как они дают максимальную работу. Гальванический элемент будет термодинамически обратимым в том случае, когда его ЭДС полностью компенсирована напряжением от внешнего источника тока и в элементе не происходят ни химические реакции, ни какие-либо другие изменения. Гальванический элемент состоит из двух различных полуэлементов, соединенных токопроводящей жидкостью и проводником. Полуэлемент представляет собой электрод, опущенный в водный раствор электролита с одноименным ионом. Под электродом в данном случае подразумевается любой металл, находящийся в контакте с электролитом. В полуэлементе происходит переход положительных ионов из поверхностного слоя металла в раствор, иными словами растворение электрода. При этом металлическая пластина заряжается отрицательно (избыток электронов металлической решетки), а на границе электрод – раствор возникает двойной электрический слой за счет электростатического взаимодействия. Создается пограничная разность потенциалов, называемая электродным потенциалом. Через какой-то промежуток времени растворение электрода прекращается, так как устанавливается состояние динамического равновесия между процессами растворения металла и осаждения его на пластине. Состояние равновесия таким образом связано с зарядом металлической пластины, т.е. с электродным потенциалом. Различные металлы будут иметь различные значения электродных потенциалов. Определить абсолютное значение электродного потенциала так же, как и термодинамического потенциала, невозможно. Его определяют относительно так называемого водородного электрода сравнения, потенциал которого условно принят равным нулю. Электродный потенциал меняется с концентрацией электролита. Эта зависимость следует из принципа Ле-Шателье, которому подчиняется равновесие: Ме Û Меn+ + nē При увеличении концентрации ионов Меn+ равновесие смещается влево (), т.е. происходит осаждение ионов металла на пластине. Уменьшение же концентрации ионов Меn+ наоборот способствует растворению металла, смещая равновесие в правую сторону (®), а следовательно, и увеличению электродного потенциала. Поэтому сравнивать электродные потенциалы можно лишь при одинаковых концентрациях. Потенциал, измеренный относительно стандартного водородного электрода при концентрации ионов металла в растворе, равной 1 г-ион/л, называется стандартным электродным потенциалом (условия стандартные: Р =100 кПа, t =298 К). Стандартные электродные потенциалы металлов сведены в электрохимический ряд напряжений. В этом ряду каждый предыдущий металл активнее последующего и поэтому может его вытеснить его из раствора. Чем больше численное значение электродного потенциала атома или иона, тем больше его окислительные свойства (стремление к приему электронов), а чем более отрицательным является значение электродного потенциала, тем больше его восстановительные свойства (стремление к потере электронов, ионному растворению). Таким образом, электродные потенциалы характеризуют окислительно-восстановительные свойства в растворе. Разность электродных потенциалов (окислителя и восстановителя) составляет электродвижущую силу (ЭДС) гальванического элемента. Стандартная ЭДС – это ЭДС элемента, в котором все константы находятся в стандартном состоянии. ЭДС, изобарный потенциал и константа равновесия. Максимальная электрическая работа, совершаемая обратимым гальваническим элементом, равна произведению ЭДС элемента Е0 и количества электричества nF кулонов.
А0max=E0nF. (1)
А как известно, максимальная работа в условиях обратимости равна уменьшению энергии Гиббса при химической реакции, поэтому
DG0=-E0nF. (2)
Из уравнения (2) следует, что химическая реакция элемента происходит самопроизвольно (DG<0), если ЭДС обратимого элемента имеет положительное значение (Е0>0). А так как DG0 связана с константой равновесия реакции уравнением DG0=- R T ln K, (3)
то объединяя уравнения (3) и (2), имеем при равновесии
или
При большом значении ЭДС имеем большую величину константы равновесия, это означает, что один из компонентов расходуется почти полностью. Зная Е0 можно определить не только направление окислительно-восстановительного процесса, но и степень его протекания, т.е. Кравн. Из термодинамического соотношения DG=DH-TDS следует, что для процессов, происходящих в растворах при комнатных температурах, DG»DH, так как изменение энтропии невелико. При этих условиях уравнение (2) превращается в выражение (5): DH0= -Е0 nF. (5)
Эта формула очень важна в практическом отношении, так как позволяет легко определить Е0 только по изменению энтальпии в электродном процессе, вычисленной по закону Гесса. Электродный процесс складывается из момента отрыва иона от кристаллической решетки металла в процессе ионизации и перевода его в раствор, где он гидратируется
DНиониз Ме Û Меn++ ne- DНгидр
где DН0 – энтальпия электродного процесса. DНиониз – энергия ионизации. Следовательно, энтальпия электродного процесса (DН0) равна сумме энергии ионизации DНиониз>0 и теплоты гидратации DНгидр<0. Именно этим объясняется, например, то обстоятельство, что литий обладает большими восстановительными свойствами в растворе (более отрицательное значение электродного потенциала), чем натрий, несмотря на то, что DНионизLi>DНионизNa. Вследствие малого размера иона лития, он обладает большей теплотой гидратации. Следовательно, в данном случае реакционная способность, характеризуемая DG(Е), определяется только энергетикой процесса (DНгидр) без учета DS. Конечно все это не означает, что можно во всех случаях пренебрегать энтропийной составляющей величины DG и преувеличивать роль Е0 (и, в частности, энергии гидратации) а определении направления процесса. Уравнение Нернста служит для определения электродных потенциалов при С¹1. Для того чтобы катионы металла перешли в раствор соли, имеющей с ним одинаковый катион, нужно совершить работу. Если принять, что процесс происходит при постоянной температуре и полагая, что концентрация катионов в растворе равна С, а концентрация одноименных ионов, переходящих с металла в раствор, равна С0, то работа А этого процесса будет равна:
где R – газовая постоянная, выраженная в джоулях, а Т – абсолютная температура. В условиях работы гальванического элемента
А=E nF, (7)
где Е – электродный потенциал; n – валентность металла; F – число Фарадея. Подставляя из формулы (6) вместо А равное ей значение, получим:
или
Это, так называемое, уравнение Нернста для определения электродных потенциалов. При концентрации ионов в растворе, равной 1 грамм-иону в литре, электродный потенциал называется стандартным и обозначается через Е0. Выразим уравнение Нернста через стандартный электродный потенциал:
при С =1
и
Выражая в уравнении Нернста R, T и F через их значения и переводя натуральные логарифмы в десятичные, получим для 250С (298 К)
Следовательно, уравнение (12) можно написать таким образом:
Таким образом, если нам будут известны значения стандартных электродных потенциалов, то значения их при любых концентрациях ионов в растворе легко определить из формулы (14).
ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ И ЭДС
Всякое устройство, с помощью которого химическую энергию можно перевести в электрическую, называется гальваническим элементом. Если пластинки двух различных металлов опустить в растворы их солей и внешние концы пластинок соединить проводником, а растворы - электролитическим мостиком, то по проводнику растворы будут переходить от более активного металла – анода (имеющего меньшее значение электродного потенциала) к менее активному металлу – катоду (имеющему большее значение электродного потенциала). Образуется гальванический элемент. Уход электронов с анода вызывает дальнейший переход его ионов в раствор – процесс окисления. На катоде одновременно происходит процесс восстановления ионов металла, находящихся в растворе. Например, в элементе Якоби-Даниеля анодом служит цинковый стержень, погруженный в раствор цинкового купороса, катодом является металлическая медь, опущенная в раствор медного купороса. Оба раствора соединены сифоном, наполненным агар-агаром с насыщенным раствором хлористого калия, а электроды металлическим проводником. При работе такого элемента цинк окисляется, а медь восстанавливается.
А: Zn-2e®Zn2+ ЕZn=-0,76В К: Cu2++2e®Cu0 ЕCu=+0,34В
В результате этой реакции получается электрический ток. Необходимо выяснить, где же возникает разность потенциалов в гальваническом элементе. Известно, что разность потенциалов возникает на границе соприкосновения физически и химически различных тел. Поэтому в элементе Якоби-Даниеля мы можем различать 4 е места возникновения разностей потенциалов: на границе электродов и их растворов возникают электродные потенциалы, между электродами – контактный потенциал и между двумя электролитами CuSO4 и ZnSO4 диффузионный потенциал. Сумма этих потенциалов и составляет электродвижущую силу данного элемента. Таким образом:
где Е – электродвижущая сила гальванического элемента; Е К – контактный потенциал; Е Д – диффузионный потенциал;
Возникновение потенциалов. На границе соприкосновения двух металлов возникает разность потенциалов: она получила название контактной разности потенциалов или просто контактного потенциала Е К. Контактный потенциал между двумя металлами зависит от соотношения их способности отдавать электроны и равен разности работ выхода электрона. Известно, что работа выхода электрона выражает количество энергии, необходимое для отделения электрона, находящегося на поверхности металла. При измерении ЭДС гальванических элементов контактный потенциал входит как слагаемое в электродные потенциалы, поэтому его значение в отдельности во внимание не принимается. Диффузионные потенциалы ЕД образуются за счет различных концентраций соприкасающихся электролитов и различной подвижности их ионов. Электродные потенциалы возникают за счет катионного растворения металлов, вследствие воздействия на него полярных молекул воды и последующей гидратации ионов. Все металлы образуют ряд напряжений, в котором каждый металл по отношению ко всем последующим будет более электроотрицателен, а ко всем предыдущим – электроположителен. Каждый металл ряд напряжений вытесняет любой стоящий правее его металл из раствора его соли и вытесняется сам любым, стоящим левее его, металлом. Так, медь вытесняется и железом и цинком. В образовании электродвижущей силы гальванических элементов главное значение принадлежит электродным потенциалам, причем следует считать, что ЭДС гальванических элементов равна разности электродных потенциалов – более положительного ЕК – катода и менее положительного ЕА – анода, т.е.
Е= ЕК – ЕА (16)
Гальванические элементы в дальнейшем будут записываться следующим образом: все фазы, составляющие элемент, записываются подряд в одну строку и отмечаются все имеющиеся поверхности раздела между ними. Гальванические элементы записываются так, чтобы отрицательный электрод (анод) располагался слева, а положительный (катод) – справа. В соответствии со сказанным, гальванический элемент Якоби-Даниеля запишется так: (А) - Zn | ZnSO4 || CuSO4 | Cu + (К). Пример 1. Вычислите электродные потенциалы свинцовой пластинки, погруженной в растворы азотнокислого свинца, в котором концентрация [Pb2+] равна 0,1 и 0,01 г∙ион/л, при условии полной диссоциации соли. Решение. Для вычисления электродных потенциалов свинца с разной концентрацией его ионов в растворах применяем формулу Нернста. 1. Концентрация ионов свинца равна 0,1 г∙ион/л.
2. Концентрация ионов свинца равна 0,01 г∙ион/л.
Пример 2. Какой металл в паре Fe-Ni будет растворяться в разбавленной серной кислоте? На каком металле будет выделяться водород? Решение. В этой паре будет растворяться железо, так как потенциал железа меньше электродного потенциала никеля.
Пример 3. Составьте схему гальванического элемента, при работе которого протекает реакция Cd + 2AgNO3 = Cd(NO3)2 + 2Ag. Выразите электронными уравнениями процессы, происходящие на электродах. Укажите анод и катод. Решение. В этом гальваническом элементе анодом будет кадмий, так как его стандартный электродный потенциал меньше электродного потенциала серебра. Электродный потенциал кадмия Схема гальванического элемента: А(-) Cd|Cd(NO3)2 || AgNO3|Ag (+)К. На электрода будут протекать реакции: на аноде Cd - 2 e = Cd2+; на катоде 2Ag+ + 2 e = 2Ag. Суммарный процесс Cd + 2Ag+ = Cd2+ + 2Ag.
Контрольные вопросы
121. Гальванический элемент состоит из свинцовой и медной пластинок, погруженных в молярные растворы их солей. Выразить молекулярными и ионными уравнениями процессы, протекающие при работе гальванического элемента. 122. Вычислите потенциалы никелевой пластинки, погруженной в 0,1М и 0,01М растворы нитрата никеля при условии полной диссоциации соли. 123. Гальванический элемент состоит из медного и никелевого электродов, погруженных в растворы их азотнокислых солей. Составьте схему этого элемента и электронные уравнения процессов, происходящих при его работе. 124. Составьте схемы двух гальванических элементов, в одном из которых медь является анодом, а в другом – катодом. Напишите электронные уравнения процессов, происходящих на электродах. 125. Процессы, протекающие на электродах при работе гальванического элемента, выражаются электронными уравнениями: Zn – 2 e = Zn2+ Ni2+ + 2 e = Ni0. Составьте схему этого элемента и напишите уравнение происходящей реакции. 126. Вычислите ЭДС гальванического элемента А (-) Ni|NiSO4 || CuSO4|Cu (+) К, зная, что [Ni2+] = [Cu]2+ = 1 г∙ион/л. Напишите электронные уравнения процессов, происходящие на электродах. 127. Какие химические процессы протекают у электродов гальванического элемента, состоящего из цинкового электрода, погруженного в раствор сульфата цинка, и угольного электрода, погруженного в раствор серной кислоты? 128. Вычислите ЭДС гальванического элемента А (-) Ni|Ni(NO3)2 || AgNO3|Ag (+) К Концентрация азотнокислого никеля равна 0,1М, азотнокислого серебра 0,01М. Напишите электронные уравнения, происходящие на электродах. 129. Вычислите ЭДС гальванического элемента А(-) Zn|Zn(NO3)2 || Pb(NO3)2 |Pb (+)К, концентрации ионов [Zn2+] и [Pb2+] соответственно равны (г∙ион/л) 0,01 и 0,1. Напишите электронные уравнения реакций, протекающих на электродах. 130. Составьте электрохимическую схему медномагниевого гальванического элемента и электродные процессы во внутренней цепи. Определите ЭДС. Составьте схему токообразующей реакции. 131. Вычислите ЭДС элемента (-) Cd/Cd2+//Ag+/Ag (+),если концентрация СAg+- = 0,1 и СCd2+ = 0,001г -ион/л. 132. Почему нельзя скреплять железные пластины между собой медными винтами, а медные – железными? Составьте электронные уравнения процессов, которые будут протекать при неправильной сборке конструкций. 133. Составьте схему гальванического элемента, в котором самопроизвольно происходит окислительно-восстановительная реакция: Zn+Pb2+=Zn2++Pb. Рассчитайте ЭДС и изменение изобарно-изотермического потенциала реакции, если концентрации ионов цинка и свинца равны 0,01 моль/л. 134. Для реакций, протекающих по нижеприведенным схемам: а) KJ+Cl2®KCl+J2. б) KMnO4+HBr®Br2+KBr+MnBr2+H2O. 1) составьте электронные уравнения и расставьте стехиометрические коэффициенты; 2) укажите окислитель и восстановитель; 3) определите направление самопроизвольного протекания; 135. Рассчитайте ЭДС элемента Zn+2Ag+«Zn2++2Ag, в котором при 298К установилось равновесие. Цинковый и серебряный электроды опущены в растворы их солей с активной концентрацией их ионов 1 моль/л. Напишите для данного гальванического элемента электронные уравнения реакций, протекающих на аноде и катоде. Составьте схему. 136..При каком условии будет работать гальванический элемент, электроды которого сделаны из одного и того же металла? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, в котором один никелевый электрод находится в 0,001 М растворе, а другой такой же электрод в 0,01 М растворе сульфата никеля. 137.рассчитайте стандартную ЭДС элемента, в котором установилось равновесие: Mg + Zn2+«Zn+Mg2++ Zn; a Zn2+=10-2 моль/л, à Mg2+=10-3 моль/л. Напишите электронные уравнения электронных процессов. 138.Рассчитайте ЭДС элемента, в котором при 298К установилось равновесие: Cd+Cu2+«Cd2++Cu; à Cu2+=10-3 моль/л, а Cd2+=10-2 моль/л. Напишите электронные уравнения электродных процессов. 139.Рассчитайте ЭДС элемента, в котором при 298К установилось равновесие: Fe+2Ag+«Fe2++2Ag, при а Fe2+=10-2моль/л, а Ag+=10-3моль/л. Напишите электронные уравнения электродных процессов. 140.Составьте схему элемента при а Аg+=10-1моль/л у одного электрода и a Аg+=10-4 моль/л у другого электрода. Укажите, какой из электродов будет анодом, а какой катодом. Рассчитайте ЭДС элемента. 141.Составьте схему элемента при a Zn2+=10-2 моль/л у одного электрода и a Zn2+=10-6 моль/л у другого электрода. Укажите, какой из электродов будет анодом, а какой катодом. Рассчитайте ЭДС элемента. 142. Определите активность ионов Cu2+ в растворе, в котором установилось равновесие: Zn+Cu2+«Zn2++Cu, если при 298 К ЭДС элемента равна 1,16 В и a Zn2+=10-2 моль/л. Напишите уравнения электродных процессов. 143.При какой активности ионов Pb2+ равновесный потенциал свинцового электрода при 298 К будет равен стандартному потенциалу никелевого электрода? 144. Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из алюминиевых электродов, опущенных: первый в 0,01 М, второй - в 0,1 М раствора Al(NO3)3. 145. Гальванический элемент составлен из стандартного цинкового электрода и хромового электрода, погруженного в раствор, содержащий ионы Cr3+. Определите концентрацию ионов Cr3+, если ЭДС этого гальванического элемента равна 0. 146. Вычислите ЭДС гальванического элемента, составленного из стандартного водородного электрода и цинкового электрода, погруженного в раствор ZnSO4, в котором концентрация ионов [Zn2+]=0,01моль/л. Составьте электронные уравнения процессов, происходящих на электродах при работе этого элемента. 147. При какой концентрации ионов алюминия значение потенциала алюминиевого электрода становится равным стандартному потенциалу водородного электрода. Составьте схему гальванического элемента и уравнения электродных процессов. 148. Составьте схему, напишите электронные уравнения электродных процессов, вычислите ЭДС медно-кадмиевого гальванического элемента, в котором Cd2+ = 0,1 моль/л, а Cu2+ = 0,01 моль/л. 149. Никелевый и кобальтовый электроды опущены соответственно в растворы Ni(NO3)2 и Co(NO3)2. В каком соотношении должна быть концентрация ионов этих металлов, чтобы потенциалы обоих электродов были одинаковыми? Составьте схему гальванического элемента и уравнения электродных процессов. 150. Гальванический элемент составлен из стандартного водородного электрода и медного электрода, погруженного в раствор своей соли с концентрацией [Cu2+]=0,1моль/л. Составьте схему, напишите электронные уравнения электродных процессов и вычислите эдс этого гальванического элемента. ЭЛЕКТРОЛИЗ
Так как в электролизе участвуют ионы целесообразно начинать составление процессов на аноде (А) и катоде (К) с написания диссоциации данного электролита. Рассмотрим, например, электролиз раствора NiSO4 с инертным анодом:

К А Составим все возможные процессы на А и К и выберем доминирующие. К катоду будут двигаться ионы Ni2+ и Н2О, а к аноду – ионы
 В (17) В (17)
2Н2О+2е®Н2+2ОН-
Т.к.
  В (18) В (18)
2Н2О -4е® О2+ 4Н+
Т.к. Однако, кроме указанных первичных процессов будут протекать и вторичные (взаимодействие ионов не участвующих в первичных процессах). В данном случае возможны вторичные процессы только в прианодном пространстве. Для протекания электролиза к электродам надо приложить минимальную величину напряжения, называемую потенциалом разложения. Так как окислительно-восстановительный процесс при электролизе имеет противоположное направление процессу в гальваническом элементе, то теоретически Е разл должен равняться ЭДС гальванического элемента с противоположным знаком. Однако на электродах протекают различные побочные процессы, связанные с массовой нейтрализацией ионов, с изменением химической природы поверхности электродов, с изменением концентраций электролитов в приэлектродных пространствах. Поэтому потенциал разложения больше величины ЭДС гальванического элемента на величину, называемую перенапряжением на электродах. Перенапряжением на электродах зависит от состава электролита, его концентрации, положения металла в ряду стандартных электродных потенциалов, плотности тока, температуры, состояния поверхности электродов. Потенциалы разложения электролитов обычно определяют опытным путем. Последовательность разряда ионов на электродах зависит от величины перенапряжения. Особенно велико перенапряжение при выделении газов на металлах. Так, при выделении водорода на цинке создается перенапряжение около 0,7 В, а Анодное выделение О2 тоже имеет значительную величину перенапряжения. Величины перенапряжений при катодном выделении металлов значительно меньше. Электрохимические процессы на электродах подчиняются законам Фарадея: 1. Количество вещества, выделенного на электродах при электролизе, прямо пропорционально количеству тока, прошедшего через электролит. 2. При электролизе различных электролитов равные количества электричества выделяют на электродах количества вещества, прямо пропорциональные их эквивалентам. При пропускании через электролит 96500 Кл электричества выделяется 1г×экв вещества. Это число обозначают через F=96500 Кл и называют числом Фарадея. Математически закон Фарадея записывается так:
где m – масса выделенного вещества, г; Э – химический эквивалент или масса 1 г×экв; Q – количество протекшего электричества, Кл; I – сила тока, А; t – время электролиза, с.
Э = а×F, (20)
здесь Э – химический эквивалент; а – электрохимический эквивалент. При электролизном выделении газов в формулу закона Фарадея вводят пропорциональные величины:
где V0 – объем выделенного газа при нормальных условиях;
Для определения выхода по току используют следующую формулу:
ЭЛЕКТРОЛИЗ С РАСТВОРИМЫМ АНОДОМ
Растворимые металлические аноды, которые окисляются, используются для очистки металлов, анодной обработки их, рафинирования, анодирования, хромированния и т.д. Для примера рассмотрим электролиз водного раствора Cu(NO3)2 с растворимым медным анодом:

Сu К А
Составим возможные процессы на аноде и катоде: К: Cu2+ +2e ® Cuo 2Н2О+2е® Н2+2ОН- Т.к.
А: 2Н2О -4е® О2+4Н+ 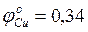 В В
Т.к.
Пример 1. Сколько граммов свинца выделится на катоде при пропускании через раствор Pb(NO3)2 тока силой 7А в течение 15 мин? Решение. В растворе содержатся ионы соли
К А
Составим возможные процессы на аноде и катоде:
2Н2О+2е® Н2+2ОН- А:
По закону Фарадея масса выделенного свинца
где t – время, с Э – химический эквивалент свинца, равный 103,6.
Пример 2. Рассчитайте, сколько выделилось водорода и кислорода при электролизе водного раствора NaOH при пропускании электрического тока в течение 2 ч 30 мин при силе тока в 3А. Решение. В растворе содержатся ионы Na+ и ОН- и молекулы Н2О. В соответствии с порядком разряда ионов на электродах идут процессы:
К А
К: Na+ +e ® Nao
Т.к.
А: 4 ОН- -4е ® 2Н2О+О2 2Н2О -4е® О2+4Н+ Т.к. По закону Фарадея
Пример 3. Какие процессы протекают при электролизе раствора AgNO3 с инертным анодом, с серебряным анодом? Сколько выделится вещества на инертном аноде если на катоде образовалось 10,8 г серебра? Решение.
Ag К А
В обоих случаях на катоде преобладает процесс ( К: Ag+ + е®Ago, а на аноде в случае инертного анода преобладает процесс окисления Н2О А: 2Н2О -4е® О2+4Н+ с серебряным анодом А: Ag - е® Ag+ Происходит растворение анода На основе второго закона Фарадея имеем, что при выделении 1 г×экв. Ag (108г) выделится 1 г×экв. O2 (5,6 л), тогда образование 10,8г Cu соответственно даст 108 г - 5,6 л 10,8 г - Х
Контрольные вопросы.
151. Сколько электричества надо пропустить через раствор NaCl, чтобы получить 500 кг NaOH? 152. Какое количество металлов выделится при электролизе расплавов MgCl2 и CaCl2 при пропускании тока силой 4А в течение 5 ч? 153. Сколько времени пропускали через раствор щелочи ток силой 3А, если при этом выделилось 2,24 л кислорода, измеренного при нормальных условиях? Составьте электронные уравнения процессов, происходящих на электродах. 154. В какой последовательности протекают процессы на электродах при электролизе растворов солей равной концентрации Na3PO4, NiSO4, AgNO3, CuSO4? Составьте электронные уравнения процессов. 155. Сколько времени пропускали ток силой 8А через раствор сульфата никеля, если масса никелевого анода стала меньше на 0, 8805 г. 156. Сколько выделится металла на катоде при электролизе раствора CuSO4 при 95% выходе металла по току в течение 40 минут при силе тока в 4А? 157. Сколько граммов воды разложилось, если через раствор пропустить ток силой 5А в течение 2,5 часа? 158. Определить эквивалент олова, если при электролизе раствора SnCl2 в течение 1 часа при силе тока в 3А выделилось 6,64 г мет
|
|||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 845; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.219.203 (0.011 с.) |


 . (4)
. (4)
 DН0
DН0  ,
, (6)
(6) (8)
(8)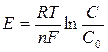 . (9)
. (9) (10)
(10) (11)
(11) (12)
(12) (13)
(13)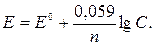 (14)
(14)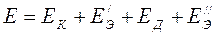 . (15)
. (15) и
и  - электродные потенциалы.
- электродные потенциалы.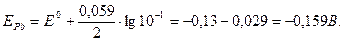

 ;
;  . Водород будет выделяться на никеле, так как никель будет катодом для данной пары, а железо будет анодом.
. Водород будет выделяться на никеле, так как никель будет катодом для данной пары, а железо будет анодом. , серебра
, серебра  Растворяться будет кадмий, а восстанавливаться - серебро.
Растворяться будет кадмий, а восстанавливаться - серебро.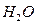
 и молекулы воды
и молекулы воды В
В »
»  близки (вторая группа катионов) на катоде будут образовываться одновременно Ni и Н2.
близки (вторая группа катионов) на катоде будут образовываться одновременно Ni и Н2. В
В <
<  на аноде будет преобладать кислород О2.
на аноде будет преобладать кислород О2.
 , поэтому при электролизе солей металлов средней активности одновременно разряжаются и ионы металла, и ионы водорода. Вследствие этого выход металла по току средний.
, поэтому при электролизе солей металлов средней активности одновременно разряжаются и ионы металла, и ионы водорода. Вследствие этого выход металла по току средний. , (19)
, (19) показывает количество вещества, выделившегося при пропускании одного кулона электричества. Это электрохимический эквивалент. Между химическим и электрохимическим эквивалентом существует зависимость
показывает количество вещества, выделившегося при пропускании одного кулона электричества. Это электрохимический эквивалент. Между химическим и электрохимическим эквивалентом существует зависимость (21)
(21) =11,2 л;
=11,2 л;  =5,6 л – объемы грамм-эквивалентов водорода и кислорода.
=5,6 л – объемы грамм-эквивалентов водорода и кислорода. . (22)
. (22) В
В >
>  на катоде образуется медь Cu
на катоде образуется медь Cu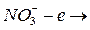 не разряжается
не разряжается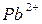 и
и  , а также молекулы Н2О. При пропускании тока на катоде восстанавливаются в основном ионы
, а также молекулы Н2О. При пропускании тока на катоде восстанавливаются в основном ионы 


 К: Pb2+ +2e ® Pbo
К: Pb2+ +2e ® Pbo 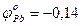 В
В В
В 2Н2О -4е® О2+4Н+
2Н2О -4е® О2+4Н+ 
 г.
г.


 2Н2О+2е® Н2+2ОН-
2Н2О+2е® Н2+2ОН-  на катоде преобладает Н2
на катоде преобладает Н2

 <
<  ;
;  л,
л,  л.
л. л;
л;  л.
л.


 >
> 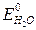 ):
):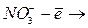 не разряжается
не разряжается
 <
< 
 л О2
л О2


