
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общие указания к выполнению контрольной работыСодержание книги
Поиск на нашем сайте
ЗАДАНИЕ НА КОНТРОЛЬНУЮ РАБОТУ И Общие указания к выполнению контрольной работы В процессе изучения курса химии студент должен выполнить одну контрольную работу. Решение задач и ответы на теоретические вопросы должны быть коротко, но четко обоснованы. При решении задач нужно приводить весь ход решения и математические преобразования. Контрольная работа должна быть аккуратно оформлена, написана четко и ясно и иметь поля для замечаний рецензента. Номера и условия задач необходимо переписывать в том порядке, в каком они указаны в задании. В начале работы следует указать учебный шифр студента, номер варианта и полный список номеров задач этого варианта. В конце работы следует дать список использованной литературы с указанием года издания. Работа должна иметь подпись студента и дату. Если контрольная работа не зачтена, ее следует выполнить повторно в соответствии с указаниями рецензента и представить вместе с не зачтенной работой. Исправления следует выполнять в конце работы, после рецензии, а не в тексте. Контрольная работа, выполненная не по своему варианту, преподавателем не рецензируется и не засчитывается как сданная. Каждый студент выполняет вариант контрольных заданий, обозначенный двумя последними цифрами номера студенческого билета (86594, две последние цифры 94, им соответствует вариант контрольного задания 94)
Варианты контрольного задания
Химическая термодинамика ТЕРМОХИМИЧЕСКИЕ ЗАКОНЫ Рассмотрим основные законы термохимии, которые являются частными проявлениями закона сохранения и превращения энергии. Первый закон термохимии обычно формулируют следующим образом: Тепловой эффект прямой реакции равен по абсолютному значению и противоположен по знаку тепловому эффекту обратной реакции. Иначе говоря, осуществив в системе какой-либо химический процесс, а затем ему противоположный, мы возвращаем систему в первоначальное состояние с той же внутренней энергией, какую она имела. При термохимических расчетах особенно важным является один из видов тепловых эффектов - теплота образования. Теплотой образования называют тепловой эффект реакции образования одного моля химического соединения из простых веществ, устойчивых при данных условиях. Например, теплота образования силиката кальция есть тепловой эффект реакции, равный 1635 кДж на 1 моль продукта: Са + Si + 3/2О2 = СаSiO3 + 1635 кДж/моль Будем в дальнейшем тепловой эффект реакции образования при стандартных условиях обозначать символом Q°298 Однако нужно понимать, что в термохимии и термодинамике приняты разные исходные положения для учета изменения энергии при химических реакциях. Термохимия, как было указано ранее, рассматривает, сколько энергии приобрела (или отдала) окружающая среда, в которой происходит химическая реакция. Термодинамика, напротив, учитывает изменения энергии, происходящие в самой реакции, т.е. при переходе исходных реагентов в продукты реакции. При этом в термодинамике тепловой эффект реакции образования, проводимой при постоянном давлении, обозначают символом DН°298 (энтальпия), который численно равен, но противоположен по знаку величине Q°298. Следовательно, эндотермическим процессам (-Q°298) соответствуют положительные значения DН°298, а экзотермическим (+Q°298) - отрицательные, т.е. - DН°298. Например, эндотермическая реакция паров воды с углем с учетом теплового эффекта может быть выражена двумя способами: Н2О(г) + Ств = СО(г) + Н2(г) - 132 кДж/моль Н2О(г) + Ств = СО(г) + Н2(г) (DН =132кДж/моль) Оба способа записи термохимического уравнения химической реакции эквивалентны и показывают, что при взаимодействии паров воды с углем происходит поглощение теплоты. Второй термохимический закон, открытый в 1840 г. известным русским химиком Гессом, является важнейшим и формулируется следующим образом:
Тепловой эффект химической реакции не зависит от пути ее протекания и определяется только начальным и конечным состоянием системы. Например, силикат кальция можно получить двумя путями: 1) из простых веществ, сжигая эквимолярные количества кальция и кремния совместно в кислороде: Са + Si + 3/2О2 = СаSiO3 (DН1) 2) из простых веществ, предварительно превращенных в оксиды: Са + 1/2О2 = СаО (DН2) Si + O2 = SiO2 (DН3) с последующим взаимодействием оксидов: СаО + SiO2 = СаSiO3 (DН4) В соответствии с законом Гесса получается: DН1 = DН2 + DН3 + DН4 Закон Гесса часто используют для определения тепловых эффектов, которые трудно или невозможно измерить непосредственно. Важным следствием закона Гесса является правило, согласно которому тепловой эффект реакции равен разности суммы теплот образования продуктов реакции и суммы теплот образования исходных веществ.
DН°x.p. = SН°обр (продуктов) - SН°обр (реагентов) (1)
Суммирование следует производить с учетом количества вещества, участвующего в реакции, т.е. с учетом стехиометрических коэффициентов в уравнении, например: Fе2О3 + 3СО = 2Fе + 3СО2 (DН°) DН° = 3DН°CO2 – DН°Fe2O3 – 3DН°CO Теплота образования всех простых веществ принята равной нулю. Знание теплот образования веществ и тепловых эффектов реакций позволяет делать приближенные, но очень важные выводы. Во-первых, чем больше по абсолютному значению экзотермический эффект образования соединения, тем оно термически устойчивее. Во-вторых, эндотермические и слабоэкзотермические соединения являются, как правило, химически малоустойчивыми и обладают более высокой реакционной способностью, чем сильно экзотермические вещества. Наконец, необходимо подчеркнуть, что значения тепловых эффектов реакций образования химических соединений, как и другие их свойства, находятся в периодической зависимости от атомных номеров элементов, образующих эти химические соединения. НАПРАВЛЕНИЕ ПРОТЕКАНИЯ ХИМИЧЕСКИХ РЕАКЦИЙ Из анализа энергетики химических взаимодействий непосредственно следует еще более важный вывод о принципиальной возможности прогнозирования многих химических реакций. Свыше 100 лет назад основой для таких прогнозов служил принцип Бертло-Томсена, согласно которому химический процесс осуществляется лишь в том случае, если он сопровождается выделением теплоты, т.е. является экзотермическим. Однако на практике оказалось, что многие эндотермические реакции довольно легко осуществляются при повышенных температурах. Теперь известно, что, помимо стремления к минимуму энергии, в физико-химических системах существует еще одна тенденция - стремление к увеличению беспорядка. Стремление к переходу в наиболее вероятное состояние характерно для всех систем. Количественной мерой беспорядка системы (неупорядоченности состояния системы) является величина S, называемая энтропией. Таким образом, с учетом вышесказанного энтропия увеличивается при расширении, плавлении веществ и т.д. Кроме того, энтропия возрастает при переходе вещества из кристаллического состояния в газообразное (Sг>>Sж>Sтв). Величина энтропии, аналогично энтальпии, не зависит от пути протекания реакции и определяется только начальным и конечным состоянием системы, т.е. является функцией состояния системы. Более того, для расчета изменения энтропии при химической реакции также применимы соотношения, аналогичные законам Гесса и следствиям из них:
DS°x.p. = SS°обр (продуктов) - SS°обр (реагентов) (2)
Важной характеристикой состояния системы является общая энергия системы, называемая энергией Гиббса (свободной энергией системы) и определяемая соотношением:
G = H – TS (3)
Являясь функцией состояния системы, также как энтальпия и энтропия, энергия Гиббса при протекании химической реакции определяется следующим образом:
DGx.p. = DНx.p. – ТDSx.p. = SDGобр (продуктов) - SDGобр (реагентов) (4)
Важным свойством энергии Гиббса является ее способность определять направление протекания химического процесса. Если изменение энергии Гиббса химической реакции меньше нуля (DG<0), то при отсутствии внешних воздействий в нормальных условиях процесс протекает в сторону образования продуктов реакции. Если же это изменение является положительной величиной (DG>0), то процесс может протекать в сторону образования исходных веществ. Из условия DG = 0 (состояние равновесия) можно рассчитать равновесные количества веществ, находящихся в равновесном состоянии.
Пример 1. Вычислите изменение изобарно-изотермического потенциала DG для реакции SnO2(к) +Sn(к) = 2SnO(к) при стандартных условиях. Может ли эта реакция протекать самопроизвольно при стандартной температуре, и если нет, то рассчитайте при каких температурах этот процесс осуществим? Решение: Находим из табл. 6 приложения стандартные значения энтальпии DН0(SnO2)= -581,17 кДж/моль, DН0(SnO)=-286,17 кДж/моль, олово - простое вещество следовательно DН0(SnО)=0. S0(SnO2)=52,3 Дж/моль·К, S0(Sn)=51,4 Дж/моль·К, S0(SnO)=56,7 Дж/моль·К. Изменение энергии Гиббса (изобарно-изотермического потенциала) процесса выражается через величины изменения энтальпии и энтропии: D G =D H - T D S, где Т – абсолютная температура. Для вычисления D H иD S данной химической реакции используем соотношения, следующие из закона Гесса: D Н =2D Н0 (SnO)- DН0 (SnO2)=2(-286,17)-(-581,17)=9,17 кДж, D S =2 S0 (SnO)- S0 (SnO2)- S0 (Sn)=2(56,7)-52,3-51,4=9,7 Дж/К.
Учитывая размерности величин D Н иD S, подставив в выражение для расчета D G0 значение стандартной температуры Т=298 К - получаем D G0 =9,17-298·9,7·10-3=6,3 кДж. Таким образом, изменение свободной энергии оказывается положительным. Следовательно, при стандартных условиях процесс восстановления SnO2 оловом невозможен. Пример 2. Прямая или обратная реакция будет протекать при стандартных условиях в системе: СН4(г)+СО2(г)Û2СО(г)+2Н2(г) Решение. Для ответа на вопрос следует вычислить DG0298 прямой реакции (значения DG0298 соответствующих веществ приведены. Зная, что DG0298 есть функция состояния и что DG для простых веществ, находящихся в устойчивых при стандартных условиях агрегатных состояниях, равны 0, находим DG0298 процесса по формуле: DG0х.р.=åDG0образ.пр.-åDG0образ.исх. DG0х.р.=2(-137,27)+2(0)-(-50,79-394,38)=+170,63 кДж То, что DG0298>0, указывает на невозможность самопроизвольного протекания прямой реакции при Т=298 К и равенстве давлений взятых газов 1,013×105 Па (760 мм рт.ст.=1 атм). Пример 3. Реакция восстановления Fe2O3 водородом протекает по уравнению Fe2O3 (к)+3Н2 (г)=2Fe (к)+3Н2О (г), DН=+96,61 кДж. Возможна ли эта реакция при стандартных условиях, если изменение энтропии DS=0,1387 кДж/(моль×К)? При какой температуре начнется восстановление Fe2O3? Решение. Вычисляем DG0 реакции: DG0Т=DН0-ТDS0=96,61-298×0,1387=+55,28 кДж. Так как DG0>0, то реакция при стандартных условиях невозможна; наоборот, при этих условиях идет обратная реакция окисления железа (коррозия). Найдем температуру, при которой DG=0: DН=ТDS; Следовательно, при температуре»696,5 К, начнется реакция восстановления Fe2O3. Иногда эту температуру называют температурой начала реакции.
Контрольные вопросы. 1. Вычислите тепловой эффект ∆Н реакции 2СН4(г) = С2Н6(г)+Н2(г). 2. Определите энтальпию образования SiO2 (кварц), если энтальпия реакции SiO2 (к, α–кварц)+2С (к. графит)=SiO(к)+2СО(г)+689,9кДж. 3. Укажите, в каком направлении повышается устойчивость карбонатов: MgCO3(к); CaCO3(к); BaCO3(к). 4. Известны значения энтропии для следующих реакций: а) 2ZnS(к) + ЗО2(г) = 2ZnО(к) + 2SО2(г); DS0 = - 147 Дж/(К∙моль) б) СuС12(к) + Н2О(г) = СuО(т) + 2НС1(г); DS0 = + 120 Дж/(К∙моль) в) U(к) + 2ВаF2(к) = UF4(к) + 2Ва(к); DS0 = 32 Дж/(К∙моль) На основании этих данных укажите преимущественное направление самопроизвольного протекания этих реакций в изолированной системе. 5. Укажите, изменяется ли энтропия изолированной системы, в которой протекают обратимые фазовые переходы; а) Н2О(ж) «Н2О(к) б) J2(к) «J2(г) 6. К какому значению стремится энтропия кристалла при Т→ 0,00 К? Ответ обоснуйте. 7. В справочнике приведены три значения стандартной энтропии для следующих веществ: J2, S0= 137, 261, 116 Дж/(К∙моль) К, S0= 160, 71, 65 Дж/(К∙моль) Н2О, S0 = 39, 70, 189 Дж/(К∙моль) Какому агрегатному состоянию этих веществ соответствует каждое значение S0? 8.При каких знаках энтальпия D Н и энтропия D S становятся факторами, способствующими полноте протекания самопроизвольной реакции в закрытой системе при Р, Т = const? 9.Проанализируйте уравнение DG=DH-TDS и укажите, как зависит DG от температуры, если а) DS < 0, б) DS > 0, в) DS = 0 Укажите критерий протекания самопроизвольных реакций в закрытой системе при DS=0. 10.Исходя из значений стандартной энергии Гиббса реакций а) СS2(ж) + ЗО2(г) = СО2(г) + 2SO2(г); DG0298 = - 1058 кДж б) А12Оз(к) +.2Сr(к) = Сr2Оз(к) + 2А1(к); DG0298 = + 523 кДж в) 2РbS(к) + ЗО2(г) = 2РbО(к) + 2SO2(г); DG0298 = - 483 кДж г) Н2(г) + 2С(к) + N2(г) = 2НСN(ж); DG0298 = + 252 кДж Определите направление их преимущественного самопроизвольного протекания в закрытой системе. 11Ответьте, как влияет температура на вероятность осуществления процессов: а) разложение веществ б) синтез веществ 12. Оцените величины Fe2O3(к)+ 3/2C(к) = 3/2 CO2(г) + 2Fe(к) На их основе определите условия её протекания. 13. Известно, что значительную часть шлаков составляет алюминий. В виде какого соединения он находится? Дайте объяснение этого факта. 14. По представленным значениям стандартной энергии Гиббса реакций [HgJ4]2-+S2-=HgS + 4J- [HgJ4]2-+Н2S+H2O=HgS+2Н3О+ + 4J- [HgJ4]2-+2OН-=HgO+ 4J- + Н2О Определите, каким реактивом наиболее легко разрушить в водном растворе тетраиодомеркурат (II)-ион. 15. При сгорании 1 л ацетилена (н.у.) выделилось 56 кДж теплоты. Вычислите теплоту образования ацетилена С2Н2, DG0298. 16. Вычислите DН0, DS0, DG0500 реакции Fe2O3(к)+3Н2=2Fe(к)+3Н2О(г). 17. Реакция протекает по уравнению TiO2(к)+2С(к)=Ti(к)+2СО(г). Вычислите DН0, DS0, DG01000. Возможна ли эта реакция? 18.В ходе доменного процесса возможна реакция Fe3O4(к)+СО(г)=3FeO(к)+СО2(г). При какой температуре начнется эта реакция, если DН=+34,5 кДж? 19. Напишите термохимическое уравнение реакции взаимодействия газообразных аммиака и хлористого водорода. Сколько теплоты выделится в ходе этой реакции, если было израсходовано 100 л аммиака? 20. При гашении извести СаО водой выделяется 32,5 кДж теплоты. Напишите термохимическое уравнение реакции и определите энтальпию образования оксида кальция. 21. Предложите знак изменения энтропии в реакции СаО+СО2=СаСО3. Ответ подтвердите расчетом. 22. При сгорании 1 л водорода выделяется 12,76 кДж. Рассчитать энтальпию образования воды. Какая вода получается в результате этого процесса – пар или жидкость? 23. Ответьте, как влияет температура на вероятность осуществления процессов: а) разложение веществ б) синтез веществ? 24. Оцените величины DН и DS реакции Fe2O3+3/2С(к)=3/2СО2(г)+2Fe(к). На их основании определите условия ее протекания. 25. В чем смысл одного из названий функции «G» - «свободной энергии»? Чему равна «связанная энергия»? 26. Исходя из данных для реакций окисления мышьякового ангидрида кислородом и озоном: As2O3(к)+O2(г)=As2O5(к); DН01=-270,70 кДж, 3As2O3(к)+2O3(г)=3As2O5(к); DН02=-1095,79 кДж, вычислите изменение энтальпии при переходе 1 моля кислорода в озон. 27.При сгорании 1 моля СН3СООН(ж) до СО2(г) и Н2О(ж) выделяется 871,69 кДж/моль. Вычислите энтальпию образования уксусной кислоты (DН0обр,298), если известно: С(графит)+О2(г)=СО2(г); DН0298=-393,51 кДж/моль, Н2(г)+1/2О2(г)=Н2О(ж); DН0298=-285,85 кДж/моль. 28. Пользуясь таблицами DG0обр,298 и S0обр,298, определите возможен ли самопроизвольный процесс Al2O3(к)+3SO3(ж)=Al 2 (SO4 )3 (к) при 298 К. 29. Пользуясь таблицами DG0обр,298 и S0обр,298, вычислите DG0298 и DS0298 реакции Zn(NO3)2(к)=ZnO(к)+2NO2(г)+1/2О2(г). 30. Пользуясь таблицами DG0обр,298 и DS0обр,298:а) вычислите DН0298 для реакции 4Fe(OH)2(тв)+О2(г)+2Н2О(ж)=4Fe(OH)3(тв), б) вычислите DН0298 Н2SО4(ж). ХИМИЧЕСКАЯ КИНЕТИКА
Химическая кинетика - учение о закономерностях протекания химических реакций. Кинетика рассматривает две важные и взаимосвязанные характеристики реакций: скорость и механизм, знание которых позволяет управлять реакциями, выбирать оптимальные условия для их протекания. скорость химической реакции определяется числом столкновений активных реагирующих частиц, происходящих в единицу времени в единице объема (для гомогенных реакций), или на единице поверхности раздела фаз (для гетерогенных реакций), приводящих к образованию нового вещества. за скорость химической реакции принимают изменение молярной концентрации вещества за единицу времени в единице реакционного пространства. При этом безразлично, какие из реагирующих веществ выбирать для наблюдения за скоростью, так как они связаны между собой одним уравнением реакции. Например, молярная концентрация одного реагирующего вещества в момент времени τ1 равна С1, а в момент времени τ2 равна С2, тогда средняя скорость данной реакции
молярная концентрация показывает, сколько молей вещества содержится в 1 литре раствора или объема газовой смеси, время измеряется в секундах. Чтобы вычислить скорость реакции, нужно знать, как изменилась концентрация одного из реагирующих веществ за определенный промежуток времени. Чем меньше интервал времени, тем ближе экспериментально найденная скорость к истинной, то есть к скорости в данный момент. Скорость реакции всегда положительная величина, поэтому дробь берется со знаком минус в том случае, когда изучают изменение концентрации исходного вещества при реакции (С2<С1; Для определения скорости процесса можно выбрать реакцию, для которой появление определенного количества продукта фиксируется визуально, например, получение осадков. Таким образом, промежуток времени от момента слива растворов до появления осадка обратно пропорционален скорости реакции, поэтому 1/
где · от давления (в случае реакций с участием газов, так как с изменением давления изменяется концентрация); · от освещения; · от степени измельчения для реакции с участием твердых веществ. ЗАВИСИМОСТЬ СКОРОСТИ РЕАКЦИИ ОТ КОНЦЕНТРАЦИИ. ЗАКОН ДЕЙСТВИЯ МАСС Эта зависимость была открыта двумя норвежскими учеными – Гульдбергом и Ваге в 1867 году и русским ученым Бекетовым и названа законом действия масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степени, равной коэффициенту перед веществом в уравнении реакции. Для реакции aА + bB = сС + dD закон действия масс имеет вид:
где СА или [A] - концентрация вещества А, моль/л; СВ или [В] -концентрация вещества В, моль/л (в дальнейшем в методических указаниях используется второй способ обозначения концентрации); а и в – коэффициенты в уравнении реакции; k – коэффициент пропорциональности, называемый константой скорости. Если принять, что [A]=[B]=1 моль/л, то v= k, то есть константа скорости k численно равна скорости реакции, если концентрации реагирующих веществ равны единице. Поэтому величина k зависит от природы реагирующих веществ, температуры и действия катализатора, а от концентрации не зависит и остается постоянной при данной температуре в течение всей реакции. Рассмотрим пример гомогенной химической реакции: 2NO(г) + O2 (г)
В гетерогенной системе "газ – твердое вещество" взаимодействие веществ возможно лишь на поверхности раздела фаз. В этом случае концентрация твердого вещества остается постоянной в единице поверхности и входит в константу скорости реакции, а скорость реакции зависит лишь от концентрации газообразного вещества. Например: С(т) + О2(г) = СО2(г),
При столкновении молекул реагирующих веществ взаимодействие происходит только в том случае, если соударяющиеся частицы обладают энергией, достаточной для разрыва связи в молекулах и преодоления сил взаимного отталкивания их электронных оболочек. Такие молекулы называют активными. Энергия, необходимая для разрыва связей в молекулах реагирующих веществ и для преодоления сил отталкивания электронных оболочек молекул или атомов реагирующих веществ, называется энергией активации и обозначается Еакт., а частицы, обладающие такой энергией, называются активными. ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ РЕАКЦИИ. ПРАВИЛО ВАНТ-ГОФФА Количественная зависимость скорости реакции от температуры выражается эмпирическим правилом Вант-Гоффа (1884 г.): при повышении температуры на каждые 100С скорость большинства реакций возрастает в 2-4 раза, а при понижении температуры на 100С скорость реакции во столько же раз уменьшается. Число, показывающее, во сколько раз увеличивается скорость данной реакции при повышении температуры на 100С, называется температурным коэффициентом скорости (γ).
Для большинства реакций это отношение колеблется в пределах от 2 до 4. Скорость реакции
где γ – температурный коэффициент; t01 – начальная температура; t02 – конечная температура; vt2 – скорость реакции при t02; vt1 – скорость реакции при t01. С изменением температуры изменяется константа скорости. Поэтому зависимость скорости реакции от температуры можно выразить через отношение константы скорости при (t0 + 100) к константе скорости при t0
Более точно зависимость скорости реакции от температуры выражается уравнением Аррениуса
где k – константа скорости реакции; A – предэкспоненциальный множитель (зависящий от природы вещества); EА – энергия активации, Дж/моль; R – универсальная газовая постоянная, 8,3143 Дж/моль К; e – основание натурального логарифма (2,718) В химической кинетике часто пользуются уравнением Аррениуса в логарифмической форме
Из уравнения (8) следует, что зависимость константы скорости от температуры, построенная в координатах lnk –1/Т, линейна (рис.1) Эта зависимость позволяет определить энергию активации реакции EА по тангенсу угла наклона прямой и предэкспоненциальный множитель A по отрезку, отсекаемому на оси ординат, когда 1/Т=0
Чем больше величина энергии активации, тем меньше доля активных частиц, столкновение между которыми ведет к химической реакции, то есть тем меньше константа скорости. Таким образом, экспоненциальный фактор e-E/RT выражает долю частиц от их общего числа, обладающих достаточным запасом энергии для протекания процесса в случае их столкновения. Столь резкое влияние температуры на скорость реакции объясняется увеличением относительного количества активных частиц и увеличением числа столкновений между ними, что ведет к увеличению скорости реакции. Пример 1. Как изменится скорость реакции 2NO(г.)+O2(г.)→2NO2(г.) если уменьшить объём реакционного сосуда в 3 раза? Решение. До изменения объёма скорость реакции выражалась уравнением v = k [NO]2[O2]
Вследствие уменьшения объёма концентрация каждого из реагирующих веществ возросла в 3 раза. Следовательно, теперь v1 = k (3[NO])2(3[O2])=27 k [NO]2[O2] Сравнивая выражения для v и v1 видим, что скорость реакции возросла в 27 раз. Ответ: скорость реакции возросла в 27 раз. Пример 2. Во сколько раз увеличится скорость химического процесса, если температура в системе повысилась с 800С до 1100С, т.е. на 300 при температурном коэффициенте γ=3? Решение. Ответ. Приповышении температуры с 800 до 1100С скорость реакции увеличится в 27 раз. Пример 3. Для некоторой реакции первого порядка константа скорости реакции при Т1= 100С k1= 1,08·10-4, а при Т2= 600С k2= 5,484·10-2. Определите температурный коэффициент скорости и энергию активации этой реакции. Решение. По эмпирическому правилу Вант-Гоффа Из уравнения Аррениуса следует, что
Подставив численные значения величин с учетом их размерности, получаем:
8,314·1884,78·6,23=97624, т.е. искомое значение энергии активации данной реакции Еа =97,624 кДж/моль.
Контрольные вопросы. 31. Как изменится скорость реакции N2 +3H2 Û 2NH3,, если увеличить концентрацию [N2] и [H2] в два раза? 32. Реакция идет по уравнению: 2NO + O2 = 2 NO2. Концентрация исходных веществ: [NO] =0,03 моль/л, [O2] = 0,05 моль/л. Как изменится скорость реакции, если увеличить концентрацию кислорода до 0,1 моль/л, а концентрацию NO до 0,06 моль/л. 33. Чему равна скорость химической реакции 2С(т.) + О2 Û 2СО2, если [O2] = 2,8 моль/л, константа скорости k=0,5? 34. Реакция идет по уравнению: 2NO + O2 = 2NO2. Концентрация исходных веществ:[NO]=0,049 моль/л, [O2] = 0,01 моль/л. Вычислите концентрацию этих веществ в момент, когда [NO2] = 0,005 моль/л. 35. Как записать выражение закона действующих масс для следующих простых реакций? 2H2(г) + O2(г) = 2H2O(г); O2(г) + 2Zn(к) = 2ZnO(к). 36. Как изменится скорость реакции 2NO(г) + Cl2(г) =2NOCl(г) при увеличении концентрации NO(г) в 3 раза? 37. Реакция H2 + J2 =2HJ протекает с заметной скоростью с образованием активированного комплекса. Объясните её механизм. 38. Константа скорости реакции, протекающей по схеме 2А+В®С, равна 5×10-4. Вычислите скорость реакции, если концентрации веществ А и В соответственно равны 0,6 и 0,8 моль/л. 39. При какой температуре следует проводить реакцию, чтобы скорость ее была в 10 раз меньше скорости реакции, проводимой при 500С? Температурный коэффициент скорости реакции равен 2,5. 40. При 1500С некоторая реакция заканчивается за 16 мин. Вычислите за какое время закончилась бы эта же реакция при 2000С. Температурный коэффициент скорости реакции равен 3. Рассчитайте энергию активации реакции. 41. Вычислите, во сколько раз уменьшится скорость реакции, если понизить температуру от 120 до 800С. Температурный коэффициент скорости реакции равен 3. 42. Реакция идет по уравнению Н2+J2=2HJ. Константа скорости этой реакции при 5080С равна 0,16. Исходные концентрации реагирующих веществ были: [Н2]=0,04 моль/л; [J2]=0,05 моль/л. Вычислите начальную скорость реакции и скорость ее, когда [Н2] стала равной 0,003 моль/л. 43. Во сколько раз изменится скорость реакции 2А+В→А2В, если концентрацию вещества А увеличить в 2 раза, а концентрацию вещества В уменьшить в 2 раза? 44. Во сколько раз следует увеличить концентрацию вещества В2 в системе 2А2(г.)+В2(г.) →2А2В(г.), чтобы при уменьшении концентрации вещества А в 4 раза скорость реакции не изменилась? 45. В 2 сосуда одной и той же вместимости помещены: в первый – 1 моль газа А и 2 моля газа В, во второй – 2 моля газа А и 1 моль газа В при одинаковой температуре. Будет ли различаться скорость реакции между газами А и В в этих сосудах, если скорость реакции выражается: а) уравнением v1= k1 [А][В]; б) уравнением v2= k2 [А]2[В]? 46. Через некоторое время после начала реакции 3A+B→2C+D концентрации веществ составляли: [A]=0,03 моль/л; [B]=0,01 моль/л; [C]=
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 336; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.255.63 (0.01 с.) |

 и энтропии
и энтропии  образования веществ, участвующих в реакции:
образования веществ, участвующих в реакции:
 и
и  реакции
реакции =-127 кДж
=-127 кДж .
.
 <0).
<0). называется относительной скоростью реакции.
называется относительной скоростью реакции. ,
,
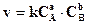 или
или
 2NO2 (г)
2NO2 (г)

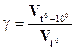 ,
,
 при любой температуре t02 можно вычислить по формуле
при любой температуре t02 можно вычислить по формуле ,
,
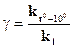 ,
,




 поскольку скорость реакции прямо пропорциональна константе скорости, подобное соотношение можно применить и к константам скорости при различных температурах, в данном случае:
поскольку скорость реакции прямо пропорциональна константе скорости, подобное соотношение можно применить и к константам скорости при различных температурах, в данном случае:  , т.е. k2=k1·g 5. Вычислив значение выражения
, т.е. k2=k1·g 5. Вычислив значение выражения  , получаем g =3,48.
, получаем g =3,48. .
. [Дж/моль].
[Дж/моль].


