
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
II закон термодинамики. Равновесные и неравновесные, обратимые и необратимые, самопроизвольные и несамопроизвольные процессы. Постулаты Клаузиуса и томсона. Цикл Карно.
Равновесные и неравновесные, обратимые и необратимые, самопроизвольные и несамопроизвольные процессы.
Р Р Р
V V V (а) (б) (в) Рис. (а), (б), (в) - графики изотермического расширения идеального газа, находящегося в сосуде под давлением (см. лекцию 1); внешнее давление многократно ступенчато уменьшается. Рис. (а): точки на кривой - точки состояния равновесия. Рис. (б): процесс протекает между теми же исходным и конечным состоянием, но скачки P и V здесь меньше, чем на рис. (а); кривые прямого и обратного процессов сблизились, число равновесных остановок возросло. Изменяя давление последовательно и многократно на бесконечно малую величину, мы можем провести процесс так, что система будет находиться в каждый момент времени бесконечно близко к равновесию. Тогда кривые прямого и обратного процесса станут бесконечно близко друг к другу и к равновесной кривой, заключенной между ними. В этом процессе работа расширения, совершаемая системой, будет наибольшей. Такой процесс будет протекать бесконечно медленно, т.к. число скачков будет бесконечно велико, а время, необходимое для совершения одного скачка, конечно. Рис. (в): процесс проходит в прямом и обратном направлении через одни и те же состояния, бесконечно близкие к равновесию; этот процесс называется равновесным. Работа равновесного процесса имеет максимальную величину по сравнению с неравновесными процессами (рис. а и б) и называется максимальной работой. Если равновесный процесс протекает в прямом, а затем в обратном направлении так, что не только система, но и окружающая среда возвращается в исходное состояние и в результате процесса не остается никаких изменений во всех участвовавших в процессе телах, то процесс называется обратимым. Иногда равновесный процесс называют обратимым изменением системы. Равновесный процесс - предельный тип процесса, абстракция; реальные физические и химические процессы всегда в большей или меньшей степени неравновесны. Само понятие «равновесный процесс» противоречиво: равновесие - и процесс. Термодинамика вынуждена использовать в своих теоретических исследованиях понятие равновесных процессов, особенно в связи со II ЗТ. I ЗТ в форме его основных уравнений приложим в равной мере и к равновесным, и к неравновесным процессам, однако расчеты по I ЗТ во многих случаях могут быть количественно проведены только для равновесных процессов (вычисление работы).
Пример равновесных процессов - идеальные механические процессы, протекающие без трения. Примеры крайних случаев неравновесных процессов: переход теплоты от тела с большей Т к телу с меньшей Т; переход механической работы в теплоту при трении; расширение газов в пустоту; самопроизвольное смешение газов или жидкостей путем диффузии; взрыв смеси горючего с окислителем. Эти процессы не могут быть проведены в обратном направлении через те же промежуточные состояния, что и прямые процессы. Неравновесные процессы протекают с конечной, иногда большой, скоростью; при этом система, являющаяся неравновесной, изменяясь, приближается к равновесию. С наступлением равновесия (сравниваются Т тел, газы и жидкости смешаются...) процесс заканчивается. Очевидно, что все неравновесные процессы протекают в направлении достижения равновесия и протекают «сами собой», т.е. без воздействия внешней силы. Очевидно также, что обратные по направлению процессы будут удалять систему от равновесия и без внешнего воздействия не могут пойти. Процессы, протекающие сами собой и приближающие систему к равновесию, являются самопроизвольными (положительными). Процессы, не могущие протекать сами собой, без воздействия извне, удаляющие систему от равновесия - несамопроизвольные (отрицательные). В изолированной системе, где исключены внешние воздействия, могут протекать только самопроизвольные процессы. Т.о., по эмпирическому признаку - возможности протекания процесса без сопровождения каким-либо другим процессом - все реальные процессы делятся на два типа: положительные и отрицательные. Равновесные процессы лежат на границе между этими двумя классами процессов, не относясь к какому-либо из них.
ЦИКЛ КАРНО. В машинах, производящих работу (тепловых машинах, например), определенное количество какого-либо вещества, называемое рабочим телом, совершает циклическую последовательность процессов, периодически возвращаясь в исходное состояние. Таким путем достигается превращение теплоты в работу.
Важнейшим из обратимых циклов является цикл Карно. Он состоит из 4 процессов. Рассмотрим цикл Карно для 1 моля идеального газа. 1). Изотермическое расширение при Т = Т1: газ находится в контакте с нагревателем с Т1, получает теплоту Q1, совершает работу А1 А1 = RT1 ln 2). Адиабатическое расширение: Т1 падает до Т2
А = åA i = A1 + A2 + A3 + A4 = SABCD = RT1 ln A > 0 Þ Q1 - Q2 > 0 Þ Q1 > Q2 Внутренняя энергия идеального газа не изменилась. Работа, произведенная газом, совершена за счет теплоты Q1, поглощенной системой от некоторого источника тепла с постоянной Т1 (нагреватель). Однако только часть теплоты превращается в работу. Другая часть теплоты - Q2 - передана газом внешней среде - некоторому телу с постоянной Т2 (холодильник). Для адиабаты ВС: Т1V2g-1 = T2V3g-1 Для адиабаты AD: T1V1g-1 = T2V4g-1 Разделим эти равенства друг на друга и извлечем корень степени g-1:
A = Q1 - Q2 = RT1 ln = Q1
Отношение A/Q1 показывает, какая часть теплоты, поглощенной газом, превращается в работу; оно называется КПД цикла. В данном случае это КПД цикла Карно с идеальным газом, рассматриваемого как тепловая машина. Величина КПД (h) зависит от разности температур, между которыми работает цикл Карно: 1. Т1 = Т2: h = 0, А = 0 - получение А при Т = const невозможно; Т нагревателя и холодильника должны быть различны; 2. Т2 = 0: h = 1, А = Q1 - теоретически полное превращение Q1 в А возможно при холодильнике с Т = 0 К. Теорема Карно-Клаузиуса: КПД тепловой машины, работающей по циклу Карно, не зависит от природы рабочего тела машины, а лишь от температур нагревателя и холодильника. Цикл Карно равновесен, т.к. все составляющие его процессы равновесны. При проведении этого цикла в обратном направлении все характеризующие его величины имеют те же значения, что в прямом цикле, но обратные знаки. Теплота Q2 поглощается газом у тела с низшей Т = Т2 и вместе с отрицательной работой А цикла передается телу с высшей Т1. В сумме нагреватель получает теплоту Q1 = А + Q2. Т.о., в обратном цикле Карно А превращается в Q и одновременно теплота Q2 переносится от тела с низшей Т к телу с высшей Т. Обратный цикл Карно дает схему действия идеальной холодильной машины. КПД обратного цикла - такое же, как и у прямого. Цикл Карно для идеального газа - идеальная, не осуществимая на практике схема тепловой (холодильной) машины. В технической термодинамике рассматриваются др. циклы, более близкие к реальным процессам, и вычисляются их КПД (циклы Рэнкина и Дизеля, например). КПД тепловой машины, работающей необратимо, меньше, чем КПД машины, работающей по обратимому циклу Карно между теми же температурами.
II ЗАКОН ТЕРМОДИНАМИКИ. Из I ЗТ и вытекающих из него закономерностей нельзя сделать вывода о том, возможен ли вообще данный процесс и в каком направлении он протекает. Между тем реальные процессы протекают в определенном направлении и, как правило, не изменив условий, нельзя заставить процесс пойти в обратном направлении. Возможность предвидеть направление того или иного процесса является очень важной для науки и техники.
II ЗТ накладывает определенные ограничения на взаимные переходы энергии из одного вида в др. Он позволяет предвидеть направление течения процесса и глубину его протекания. Формулировки II закона термодинамики: 1. Постулат Клаузиуса: единственным результатом любой совокупности процессов не может быть переход теплоты от менее нагретого тела к более нагретому. Обратный указанному переход теплоты от более нагретого тела к менее нагретому - это обычный неравновесный процесс передачи тепла путем теплопроводности. Он не может быть обращен, т.е. проведен в обратном направлении через ту же последовательность состояний. Процесс теплопроводности необратим. 2. Другое опытное положение, имеющее ту же основу: единственным результатом любой совокупности процессов не может быть превращение теплоты в работу. Т.о., самопроизвольный процесс превращения работы в теплоту (путем трения) необратим, так же, как и теплопроводность. 3. Постулат Томсона: теплота наиболее холодного тела из участвующих в круговом процессе не может служить источником работы. 4. Невозможен вечный двигатель второго рода (машина, которая давала бы работу, используя энергию какого-либо источника, и имела бы Т, одинаковую с Т этого источника). ПостулатыКлаузиуса и Томсона - формулировки II ЗТ и эквивалентны друг другу, т.е. каждое из них может быть доказано на основании другого. Их можно объединить в один: единственным результатом цикла не может быть отрицательный процесс. Это наиболее широкая формулировка, но ее недостаток в том, что она требует дополнительного определения отрицательного процесса. Исходные постулаты Клаузиуса и Томсона, имея вид частных формулировок, оказываются (каждый в отдельности) совершенно достаточными для построения всех выводов, следующих из другого постулата. В цикле Карно переход теплоты в работу - отрицательный процесс. Он компенсируется положительным процессом - передачей тепла от нагревателя к холодильнику. Математическое выражение II ЗТ:
A = Q1 Лекция 5 Энтропия. Вычисление энтропии. Постулат Планка. h = 1 -
Отношение Q/Т - приведенная теплота. Вышеприведенная запись означает: алгебраическая сумма приведенных теплот по обратимому циклу Карно равна нулю.
|
||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 787; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.156.156 (0.017 с.) |



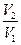 = SABba = Q1
= SABba = Q1 A
P
Q1 T1
B
D
Q2 T2
C
a d b c
V1 V4 V2 V3 V
A
P
Q1 T1
B
D
Q2 T2
C
a d b c
V1 V4 V2 V3 V
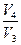 = - RT2 ln
= - RT2 ln 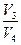 =
- SCDdc = - Q2
4). Адиабатическое сжатие:
А4 = CV (Т2 - Т1) = - CV (Т1 - Т2) =
- SDAad
=
- SCDdc = - Q2
4). Адиабатическое сжатие:
А4 = CV (Т2 - Т1) = - CV (Т1 - Т2) =
- SDAad
 =
=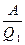 =
=  = h
= h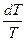
 = 1 -
= 1 - 
 -
-  = 0
= 0


