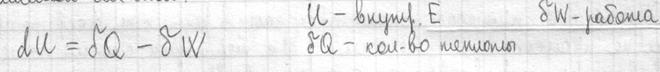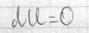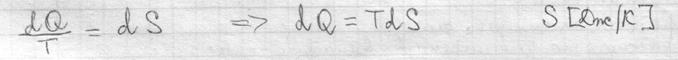Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация и характеристика термодинамических системСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Под термодинамической системой(ТС) подразумевают макроскопическое тело (состоящее из большого числа частиц), заключенное в некотором ограниченном пространстве. Термодинамические системы по характеру обмена с окружающей средой делят на: изолированные, закрытые, открытые. Изолированные ТС не обмениваются с окр средой ни веществом, ни Е. В природе таких систем нет. Закрытые ТС обмениваются с окр средой Е. Открытые ТС обмениваются с окр средой и Е и веществом. Все живые организмы являются открытыми термодинамическими системами. Изолир и закрытые ТС описывает равновесная (классическая) термодинамика. А открытые ТС изучает неравновесная термодинамика. Параметры ТС – это физические величины, которые служат для характеристики состояния системы. Параметры делятся на две категории: экстенсивные и интенсивные. Экстенсивные параметры характеризуют систему как целое. Например, масса и объем. Основное свойство параметров – их адитивность, т.е. параметр системы состоит из суммы её отдельных частей. Интенсивные параметры носят силовой характер. Это давление, температура, внутр Е. Они могут приобретать разное значение в различных точках системы. Любой вид затраченной Е можно выразить через произведение экстенсивного и интенсивного параметра. Состояние ТС-м: рановесное и неравновесное. Равновесное состояние изолированной ТС является такое состояние, в которое она приходит по истечению длительного времени (время релаксации, которое зависит от природы тела, характера взаимодействия частиц и исходного неравновесного состояния). После времени релаксации все параметры системы принимают постоянные значения и затем не изменяется. Интенсивные параметры принимают одинаковые значения во всех частях системы, поэтому равновесное состояние полностью описывается набором параметров системы интенсивных и экстенсивных. Связь между параметрами называется уравнением состояния. Уравнение состояния идеального газа описывается формулой: pV=RT Неравновесное состояние – это состояние изолированной системы, при которой интенсивные параметры имеют различные значения в различных частях системы. Поэтому в системе протекают процессы, направленные на выравнивание этих параметров и переходу системы в равновесное состояние. Состояние всех реальных систем является неравновесным.
Отличие живых объектов от неживых с точки зрения биологии и термодинамики Живой организм – открытая саморег, саморазвив. и самовоспроизводящаяся гетерогенная система, важнейшими функциональными веществами которой являются биополимеры (Б и НК). Организм – система историческая, так как развивается в процессе эволюции с момента зарождения до смерти. Неживая природа не имеет дела с историей и эволюцией. Электроны, атомы, молекулы характеризуются постоянными свойствами, не зависящими от их происхождения и на все время остаются постоянными. Следовательно, неживая природа не рассматривается как индивид природног развития. Отличительные черты живого от неживого: самовоспроизведение, саморегуляция, саморазвитие. Открытые ТС обмениваются с окр средой и Е и веществом. Все живые организмы являются открытыми термодинамическими системами.
Первый закон термодинамики I начало термодинамики показывает, что внутренняя энергия сис-мы – это кол-во теплоты, поглощенное телом за вычетом работы, совершаемой сис-мой.
Внутренняя энергия сис-мы не зависит от пути, который прошла сис-ма из одного состояния в другое, а зависит от исходного и конечного состояния. Теплота и работа зависят от этого пути. I начало термодинамики – это закон сохранения энергии. В состоянии равновесия Если отнести кол-во теплоты к t0, то получается одна из основных характеристик сис-мы – энтропия.
В термодинамической сис-ме совершаются следующие виды работы: 1) механическая dW = Fdx(F – сила, х - перемещение), если сил несколько, то dW = ∑Fidx. 2) работа по изменению объема dW0 = рdV(осмотическая работа). 3) работа электрических сил dWэ = ∑Еidq (Е- электродвижущие силы, q - заряд). 4) работа химических сил dWх = -∑nkRTD(ln Ck) (nk – число молей в-ва, R – универсальная газовая постоянная, Т – t0 абсолютная, Ck – объем, приходящийся на 1 моль). Полная запись I начала термодинамики.
В применении к биологическим сис-мам выражение для механической работы используется для описания мышечного сокращения. Электрическая работа важна для описания работы мембран. Химическая работа – для изучения ферментативной активности. Функциональная деятельность организма может быть представлена как ∑ внешних рабочих процессов. Наиболее общим свойством живой материи является способность излучать тепло. Следствием I начала термодинамики является закон Гесса – II закон термодинамики – кол-во тепла, которое выделяется при химических процессах зависит только от начального и конечного состояния сис-мы тел, и не зависит от пути по которому протекают р-ции.
|
||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 1186; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.135.127 (0.011 с.) |