
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Первичная и вторичная структура белковых молекул.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Все белки являются сополимерами, сост. из остатков оптич актив a-Ак 20 типов. Ак- это орг. карбоновые к-ты, содерж. одну или две аминогруппы. В природе распр. a-Ак:
На одном конце такой цепи всегда нах гр NH2 – N-конец, а на др. всегда COOH – C-конец. Т.к. все АК-ые остат. отл только радикалами, то белки явл квазипериодическими структ. Четыре атома H, N, C и O вход в мол Б. в виде повтор структур назыв пептидной или амидной группой:
Строение белковой глобулы. Глобулярные белки- это б. полипептидные звенья которых свёрнуты в компакт или эллипсоид структуры, кот наз глобулами. Представители таких б. – альбумины, глобулины, гистоны. Глобулярные б. вып динамические ф-ции. белковая глобула обр в клетке в водной среде. Вода влияет на водор св глобулы. для стабилизации элем 2-й структ необх чтобы образов внутримол водор св давало бы больш выигрыш своб энергии, чем обр водор св с мол воды. АК остатки могут быть условно разделены на: неполяр (гидрофоб) и поляр (гидрофил). Неполярные углеводородные радикалы АК остатков взаимод в осн друг с другом, а поляр с водой. В результ гибкая макромол сворач в глобулу. Неполяр радикалы расп внутри глобулы, а поляр гидрофил- на её поверх, соприкасаются с водой. Это предполож высказал Бреслер и Томиун в 1944г, т.е. что определяющая роль в формир простр структуры глобулы принадл гидрофоб взаимод. Идея состояла в том, что макромол Б. сворач в глобулу потому что поляр радикалы стремятся к max контакту с водой, а неполяр к min. А min поверх при задан объёме – шар. Чтобы рассчит форму глобулы необх знать отношение полярных АК к неполяр. Предполож, что все АК имеют одинак объём. Найдём соотнош числа поляр остатков к неполяр для сферич глобулы радиусом r0. Отнош поляр ост к неполяр равно отнош V этой части. Тогда параметр:
bs=Ve/Vi, где Ve – V поляр части глобулы. Vi – V неполяр части. Обозначим через S площадь поверх гидрофоб ядра (S=4pr2). Тогда: Vi= Sr/3 – объём гидрофоб ядра. Ve=S/d – объём гидрофил фазы. d- толщина мол слоя поляр остатков. Т. о. bs=Ve/Vi = 3Sd/Sr = 3d/r. b- поляр остатки, bs- неполяр. Из этого ур-я след, что чем меньше радиус глобулы, тем больше д. б. относительная гидрофильность Б. Глобула м.б. сферической только при усл., что b=bs. Если b>bs форма глобулы эллипсоидная. Если поляр остатков больше чем необх. чтобы покрыть гидрофоб ядро гидрофил слоем, то глобула вытяг в эллипс, кот имеет больш поверх чем сфера. Если b значительно меньше bs, то возм фибриллярная структ. Если b<bs, то возм надмолекуляр структ – гидрофил остатки неполностью закрыв гидрофоб, гидрофоб взаимод меж такими участками ведут к агрегации Б. и воз-ю надмолек стр-р. Формиров гидрофоб ядра имеет принципиал знач для функционир Б. Компактноупаков глобула нах. в устойчивой конформации (состоянии).
|
|||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 579; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.195.30 (0.009 с.) |

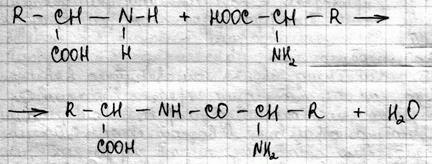
 Б. пр. соб. информац. макромол, кодирование инфо в кот осущ геном сотв Ак. В мол Б. АК-ые остатки соед. по схеме:
Б. пр. соб. информац. макромол, кодирование инфо в кот осущ геном сотв Ак. В мол Б. АК-ые остатки соед. по схеме: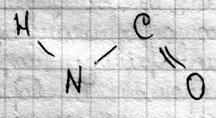 Мол Б. характ строгой последовательностью мономеров(АК), кот связаны ковалентными связями. Число и порядок мономеров в этой послед наз 1-й структурой Б. Важная особенность структуры состоит в стабилиз положений хим групп в пространстве и это положение соотв min внутр энергии. Это достигается за счет водор св. Регулярное располож хим групп в пространстве создаёт 2-ю структуру мол Б. Особенностью пептид групп явл их способ обр водород связи друг с другом, с мол воды и с др мол содержащими атомы O и N. Вследствие наличия простых одинарных связей кажд пептид группы с сосед атомом C, пептид группы могут поворачиваться вокруг оси связи относительно друг друга. Благодаря этому одинарные связи в аминокислотных остатках: C-C2, C-NH оказ гибкими. Б. м. расм как цепь связанных друг с другом плоских пептидных звеньев. Вращение звеньев возможно вокруг одинарных связей С2. 2-я структ Б. мол. имеет два основных варианта: a-спираль и b-форма. a-спираль может быть право и лево закрученной. b-форма может быть параллельна и антипараллельна. a-спиральная структура устан за счет продольных водородных связей в полипепт цепи, а b-форма- за счёт поперечных водородных связей. в белках встречаются и участки без регулярной структуры, они образ в местах пространст изгиба спирализ цепи. Возмож изгибов полипепт цепи и наличие разл взаимод в мол Б. меж группами находящихся далеко друг от друга приводят к компактной укладке цепи. Расположение в пространстве элем 2-й структ и располож неупорядоч звеньев наз 3-й структурой.
Мол Б. характ строгой последовательностью мономеров(АК), кот связаны ковалентными связями. Число и порядок мономеров в этой послед наз 1-й структурой Б. Важная особенность структуры состоит в стабилиз положений хим групп в пространстве и это положение соотв min внутр энергии. Это достигается за счет водор св. Регулярное располож хим групп в пространстве создаёт 2-ю структуру мол Б. Особенностью пептид групп явл их способ обр водород связи друг с другом, с мол воды и с др мол содержащими атомы O и N. Вследствие наличия простых одинарных связей кажд пептид группы с сосед атомом C, пептид группы могут поворачиваться вокруг оси связи относительно друг друга. Благодаря этому одинарные связи в аминокислотных остатках: C-C2, C-NH оказ гибкими. Б. м. расм как цепь связанных друг с другом плоских пептидных звеньев. Вращение звеньев возможно вокруг одинарных связей С2. 2-я структ Б. мол. имеет два основных варианта: a-спираль и b-форма. a-спираль может быть право и лево закрученной. b-форма может быть параллельна и антипараллельна. a-спиральная структура устан за счет продольных водородных связей в полипепт цепи, а b-форма- за счёт поперечных водородных связей. в белках встречаются и участки без регулярной структуры, они образ в местах пространст изгиба спирализ цепи. Возмож изгибов полипепт цепи и наличие разл взаимод в мол Б. меж группами находящихся далеко друг от друга приводят к компактной укладке цепи. Расположение в пространстве элем 2-й структ и располож неупорядоч звеньев наз 3-й структурой.


