
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Одержання перманганата каліюСодержание книги
Поиск на нашем сайте У даний час існують три методи одержання перманганата калію - хімічний, напівелектрохімічний (комбінований) з манганата калію й електрохімічний з феромарганцю. Електрохімічний метод дуже енергомісткий і тому зараз практично не застосовується. У водневому методі манганат одержують окислюванням тонкоподрібненого піролюзиту в суміші з лугом (MnO2:KOH=2,5-3:1) киснем повітря у твердій фазі в барабанних обертових печах. 2MnO2 + 4KOH + O2 = 2K2MnO4 + 2H2O Печі обігріваються за рахунок спалювання водню. Усі інші види палива дають як продукт згорання СО2, що інтенсивно взаємодіє з лугом. Температура в печі від 800-850 оС на вході до 380-400 оС на виході. При високих температурах вода випаровується і процес протікає у твердій фазі. З першої печі плав подається в другу, де підтримується температура 200-240 оС. Сюди ж для зволоження плава подається водяна пара. Ступінь окислювання піролюзиту в манганат становить близько 80%, тривалість процесу -- близько 30 годин. Технологічний процес складається зі стадій: - підготування руди і розчинення пульпи; розчинення лугу;одержання манганату; вилуговування плава манганату; центрифугування; підготування електроліту; електроліз;виділення перманганату з розчину;кристалізація перманганату -сушіння перманганату;переробка циклових розчинів лугу У кисневому методі окислювання піролюзиту здійснюється в реакторах-автоклавах з турбінними мішалками при температурі 250 оС і співвідношенні MnO2: KOH = 1:5,4. Процес триває 4-7 годин. Надлишковий тиск повітря близько 2 атм. Температура в автоклаві підтримується за рахунок тепла хімічних реакцій. Ступінь окислювання піролюзиту в манганат до 95%. Метод дозволяє працювати і з бідними рудами, тому в даний час кисневий метод вважається більш перспективним і саме цим методом одержують перманганат на Сакському хімічному заводі. До недоліків методу варто віднести необхідність застосування 78% розчину лугу. УСТАТКУВАННЯ ДЛЯ ОДЕРЖАННЯ ПЕРМАНГАНАТУ Для одержання перманганату напівелектрохімічним способом (і кисневим, і водневим методом) можуть використовуватися циліндричний і прямокутний (більш сучасний) електролізери. Циліндричний електролізер Циліндричні або круглі електролізери, застосовувані у водневому способі, мають корпус з листової сталі діаметром 2,3 м і висотою 1,2 м з похилим дном для спускання електроліту (рис. 4.41). У електролізері встановлюють 10 концентричних анодних циліндрів з нікельованої сталевої сітки і 9 катодних кілець з привареними до них залізними стрижнями діаметром 6 мм, які обгорнуто лугостійкою тканиною. Площа катодів приблизно в 10 разів менше від площі анодів, ia = 80-90 А/м2, ik = 900 А/м2. Струмове навантаження на електролізер - 5000А, напруга - 2,5-2,8 В при відстані між електродами 50 мм. Тривалість електролізу майже 2 доби, вихід за струмом 60--65%. Електроліз проводиться при перемішуванні, для чого по центрові електролізера встановлено мішалку. Електролізери такого типу відносно мало ефективні, оскільки частину їхнього внутрішнього об’єму займає перемішувальний пристрій і в цій частині простору наробітку перманганату не відбувається. Тому в даний час такі електролізери виключено з виробництва і замінено прямокутними.
Рис. 4.41. Схема циліндричного електролізера для одержання перманганату калію. 1-корпус, 2-катод, 3- анод, 4- штуцер для вивантаження готової продукції, 5-мішалка, 6-анодна шина, 7-штуцер для відведення газу, 8 - штуцер для завантаження електроліту, 9-катодна шина. Прямокутний електролізер Прямокутний електролізер (рис. 4.42) має сталевий корпус з теплоізоляцією, днище виконане під ухилом 3о і закінчується кишенею для збору кристалів перманганату. Електролізер має 20 листів анодів зі сталі Х18Н10Т і 60 невеликих катодів із Ст 3. З метою зменшення втрат перманганату внаслідок відновлення на катоді, катоди мають чохли зі склотканини, просоченої хлорвініловим лаком ХСЛ. Чохли щільно прилягають до поверхні катода. Перенесення струму через пори чохлів здійснюється переважно іонами гідроксиду, а не більш важкими і менш рухливими іонами перманганату. Це дозволяє одержувати високі виходи за струмом продукту, які сягають 95-96%. Електролізер такого типу застосовується в кисневому способі одержання перманганату. Рис. 4.42. Схема прямокутного електролізера. 1-корпус, 2-катод, 3- анод, 4- зливальний штуцер, 5 - анодна шина, 6-кришка, 7- штуцер для відведення газу, 8- штуцер для підсмоктування повітря, 9- заливний штуцер, 10-катодна шина, 11- електродвигун осьового насоса. Перемішування електроліту здійснюється пропелерною мішалкою, винесеною за межі електролізера. Це дозволило значно збільшити щільність розташування електродів у електролізному просторі та збільшити знімання продукту з одиниці площі електролізера. Крім того, такі електролізери простіші та дешевші у виробництві, ніж циліндричні. ДОПОМІЖНЕ УСТАТКУВАННЯ Концентрація перманганату в суспензії, одержуваній після електролізу, становить близько 80-125 г/л. Для виділення перманганату, розчин направляють у кристалізатор. Кристалізатор являє собою циліндричний апарат з конічним днищем, місткістю 25 м3. Він має рамну мішалку і холодильники, що охолоджують розчин до 20 оС. При охолодженні розчинність перманганату зменшується, і з розчину починають випадати кристали твердого KMnO4. Об'ємна частка кристалів у кристалізаторі становить приблизно 4%. Для подальшого “згущення” суспензія перекачується у відстійники-згущувачі (рис. 4.43).
Рис. 4.43. Схема відстійника-просвітлювача
1-шар згущеної суспензії, 2-зона вільного осадження, 3-просвітлена рідина.
Суспензію подають через патрубок, заглиблений по центрові відстійника. Кристали KMnO4 під дією сили тяжіння осідають у конічну частину апарата, а просвітлений розчин піднімається нагору і через переливний патрубок стікає в бак-збірник просвітленого розчину. Згущена суспензія безупинно самопливом надходить у центрифугу, відділені кристали направляють на перекристалізацію. Кристали розчиняють у циклових розчинах і промивній воді при 80-90 оС і направляються в бак-згущувач. Маточний розчин після згущення пульпи підігрівають і направляють на відділення кремнію в реактор каустифікації. Конструкція реактора аналогічна кристалізатору. У реактор добавляють 10-20% вапняне молоко, 3-4 м3 на 18 м3 маточного розчину. Сполуки кремнію при цьому зв'язуються в нерозчинні сполуки силікату кальцію й відокремлюються на фільтр-пресах. ОДЕРЖАННЯ ЕЛЕКТРОЛІТИЧНОГО ДІОКСИДУ МАРГАНЦЮ Властивості й одержання Сумарну реакцію електрохімічного одержання діоксиду марганцю можна записати як
Залежно від умов електролізу одержують електролітичний діоксид марганцю (ЕДМ) з різними властивостями: ЕДМ-1 - дрібнодисперсний осад з гарними каталітичними, адсорбційними та окисними властивостями і ЕДМ-2 - крупнокристалічний осад з поганими каталітичними властивостями, але добрий деполяризатор у гальванічних елементах. Вихідною сировиною є природний діоексид марганцю (піролюзит) з різними домішками. Підготування сировини полягає у відновному випалі піролюзиту, вилуговуванні та відділенні домішок. Випал роблять в обертових печах у суміші з відновником - вугіллям (85-90% руди й 10-15% вугілля) при температурі 600-800 оС або у вихрових печах. Одержуваний оксид для запобігання окислюванню киснем повітря з печей вивантажують у воду. Отриманий оксид розчиняють у відпрацьованому електроліті з підвищеним вмістом сірчаної кислоти при температурі 80-85 оС в апаратах “пачук”. Для відділення домішок металів до розчину після вилуговування добавляють вапняне молоко і сульфід натрію. Розчин відстоюється в просвітлювачах і фільтрується на рамних фільтр-пресах, після чого йде на приготування електроліту. Електроліт готують у гумованих баках при охолодженні й перемішуванні. Одержання діоксиду марганцю - періодичний процес. При електролізі процес одержання чотирьохвалентного марганцю протікає в дві стадії:
Mn(SO4)2, що утворився, піддається гідролізу і подальшій дегідратації:
Дрібнодисперсний діоксид марганцю ЕДМ-1 накопичується в об’ємі електроліту, крупнодисперсний ЕДМ-2 - осідає на електродах. Ці відміни в одержанні продукту визначають не тільки особливості технології, але конструкції електролізерів. Матеріал анодів - свинець, графіт або титан. Свинцеві й графітові аноди - одноразові. Вони руйнуються при відділенні діоксиду і тому переробляються разом з ЕДМ-2. Титанові аноди застосовуються багаторазово. Перед кожним новим застосуванням їх зачищають піскоструминним методом і протравлюють у суміші 35% HСl і 0,5-5% HF для видалення оксидної плівки. Після електролізу ЕДМ відокремлюється від розчину на фільтрах, електроди дроблять на щокових дробарках. Продукт промивають, відфільтровують і подають на сушіння в барабанні сушила. Витрата графіту становить приблизно 28 кг на 1 т ЕДМ, витрата свинцю - 20 кг. Напруга на електролізері в процесі роботи зменшується від 3,7 до 3,3, що пов'язано з підвищенням концентрації сірчаної кислоти в розчині. Широке застосування ЕДМ-2 у хімічних джерелах струму визначає переважне одержання саме крупнодисперсного діоксиду марганцю. Потреби в каталізаторах значно менші, отже, відповідно, рідше зустрічаються виробництва ЕДМ-1.
|
|||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 346; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.113 (0.007 с.) |





 ,
,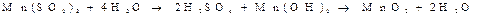 .
.


