Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекция 7. «Золотая середина» концентраций веществ в ПЦР-смесиСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Taq-полимераза Является термофильной ДНК-полимеразой (из Thermis aquaticus). Точность Taq-полимеразы зависит от концентрации Mg2+, dNTP, сбалансированности dNTP, pH. В среднем, ошибка чуть ниже, чем 1 замена на 100-300 п.н. Количество ДНК-полимеразы должно быть оптимально. Если используется слишком маленькое количество Taq-полимеразы, выход продукта снижается, причем это снижение тем серьезнее, чем больше размер продукта. При 2-4-кратном избытке Taq-полимеразы в начале реакции появляются высоко- и низкомолекулярные продукты, а при 4-16-кратном превышении продукт становится низкомолекулярным. Необходимо иметь в виду, что Taq-полимераза обладает 5’-3’ экзонуклеазной активностью. Эта активность может вызвать проблемы, обусловленные деградацией 5’ концов продукта.
Дезоксинуклеотидтрифосфаты (dNTP) Диапазон исследуемых концентраций dNTP – 0,05-0,5 mM. Чаще всего концентрация dNTP в реакционной смеси составляет 0,2 mM. Увеличение концентрации dNTP выше 0,2 mM приводит к снижению специфичности и точности ПЦР. Снижение концентрации dNTP снижает частоту ошибок фермента, однако приводит к снижению выхода ПЦР-продукта.
Ионы магния (Mg2+) Mg2+ образует комплексы с dNTP (именно эти комплексы являются субстратом для Taq-полимеразы), праймерами и матрицей ДНК и поэтому концентрация Mg2+ влияет на отжиг праймеров, температуру диссоциации матричной и амплифицированной ДНК, специфичность продукта, активность и точность ДНК-полимеразы. Для нормальной работы ДНК-полимеразы необходимо наличие свободных ионов магния, а не только тех, которые связаны с ДНК-матрицей, праймерами и dNTP. Поэтому концентрация Mg2+ в реакционной смеси должна быть на 0,5-2,5 mM выше общей концентрации dNTP. При концентрации dNTP в 0,2 mM концентрация Mg2+ обычно варьирует в пределах 1,25-1,75 mM. Слишком низкая концентрация Mg2+ - низкий выход ПЦР-продукта, слишком высокая – продукты неспецифической амплификации.
Матрица для ПЦР Количество ДНК-полимеразы в реакционной смеси может меняться в широком интервале: от 0,01 до 1 мкг на 100 мкл реакционной смеси – в зависимости от типа матрицы. Для геномной ДНК млекопитающих это количество составляет 0,5-1 мкг, для геномной ДНК бактерий – 50 нг. Необходимо иметь в виду, что при низкой концентрации матрицы необходимо использовать силиконизированные пробирки для предотвращения неспецифической абсорбции ДНК на стенках пробирки. В определенных условиях можно получить амплификацию с единичной копии матрицы. При повышении концентрации ДНК более 1 мкг/100 мкл происходит уменьшение выхода специфического продукта ПЦР из-за образования неспецифических продуктов.
Для обеспечения максимального выхода и специфичности продукта в каждом конкретном случае использования ПЦР необходимо оптимизировать условия реакции (подобрать концентрацию праймеров, ионов Mg2+, дезозоксинуклеотидов, матричной ДНК и полимеразы, подобрать время инкубации и температуру, состав инкубационной смеси (Сулимова и др., 2006).
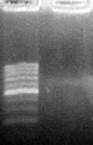
Занятие 1. Выделение ДНК Для этапа выделения ДНК используется, как правило, свежий биологический материал, в котором ДНК находится в целостном состоянии. Все факторы, которые приводят к разрыву ковалентных связей в исследуемой ДНК и загрязняют пробы чужеродной ДНК, обусловливают ошибки при проведении ПЦР и должны быть упразднены. К таковым, прежде всего, нужно отнести высокую температуру (40–50 оC и выше), электромагнитное излучение (ультрафиолет, рентгеновские лучи), радиационное излучение (α, β, γ-лучи), присутствие жизни на исследуемом материале (бактерии, грибы). Наиболее оптимальным местом хранения ДНК является морозильная камера. При температуре -5 – -20 оС ДНК в клетках может сохраняться достаточно длительное время, не разрушаясь. Для хранения материала в течение 1-2 суток используется холодильник (2-8 оC). Для выделения ДНК лучше всего подходит ткань, где клетки активно делятся и растут. Мертвая ткань и ткани опорно-трофической функции, где ДНК встречается в полуразрушенном состоянии, дают слабый выход ампликонов (фото 6).
M О М – маркер молекулярных весов ДНК (длина фрагментов от 100 до 1000 п. н. с шагом в 100 п. н.) О – отсутствие продуктов амплификации ДНК Фото 6. Отрицательная ПЦР-реакция (праймер OPA 14) с ДНК, выделенной из плавников пеленгаса Объем материала, необходимый для выделения достаточного количества ДНК, зависит от размера клеток. Чем меньше размер клеток, тем меньше необходимо исследуемого вещества. Если ПЦР состоит из 40 циклов, то теоретически достаточно и одной клетки для того, чтобы обнаружить наработанные ДНК-фрагменты. Чем меньше исследуемого материала (количества клеток), тем аккуратней нужно проводить исследование, чтобы не загрязнить пробу. При выделении ДНК используются стандартные наборы реактивов. Например, комплект «ДНК-сорб-А» фирмы «АмплиСенс» (Москва, Россия) для выделения ДНК, который имеет следующий состав: 1. лизирующий раствор; 2. отмывочный раствор; 3. сорбент универсальный; 4. ТЕ-буфер для элюции ДНК. Хранится набор при температуре 2-25 оС. Рассчитан на выделение ДНК из 100 проб.
Порядок работы. 1. Отобрать необходимое количество одноразовых пробирок. Промаркировать пробирки. 2. Растереть пробы в ступке с добавлением 100 мкл дистиллята и перенести пробы по отдельным пробиркам. 3. Лизирующий раствор (если он хранился при 2-8 оС) прогреть при 65 оС до полного растворения кристаллов. В пробирки добавить по 300 мкл лизирующего раствора. 4. Пробы тщательно перемешать на вортексе и прогреть 5 мин при 65 оС. Процентрифугировать 5 с при 5 тыс. об/мин на центрифуге. Если проба растворилась не полностью, процентрифугировать пробирку на микроцентрифуге 5 мин при 12 тыс. об/мин и использовать для выделения ДНК надосадочную жидкость, перенеся ее в новую пробирку. 5. Тщательно ресуспендировать сорбент на вортексе. В каждую пробирку отдельным наконечником добавить по 20 мкл ресуспендированного сорбента. Перемешать на вортексе, поставить в штатив (планшет) на 2 минуты, еще раз перемешать и оставить в штативе на 5 минут. 6. Осадить сорбент в пробирках центрифугированием при 5 тыс. об/мин в течение 30 с. Удалить супернатант, используя дозатор с переменным объемом и меняя наконечник для каждой пробирки. 7. Добавить в пробирки по 500 мкл раствора для отмывки, перемешать на вортексе до полного ресуспендирования сорбента, процентрифугировать 30 с при 10 тыс. об/мин на микроцентрифуге. 8. Удалить супернатант, используя дозатор с переменным объемом и меняя наконечник для каждой пробирки. 9. Повторить отмывку еще раз, следуя пункту 8., удалить супернатант полностью. 10. Поместить пробирки в термостат при 65 оС на 5-10 мин для подсушивания сорбента (осадок приобретает цвет мела). При этом крышки пробирок должны быть открыты. 11. В пробирки добавить по 100 мкл ТЕ-буфера для элюции ДНК. Перемешать на вортексе. Переместить в термостат при 65 оС на 5 мин, периодически встряхивая на вортексе. 12. Процентрифугировать пробирки при 12 тыс. об/мин в течение 1 мин на микроцентрифуге. Супернатант содержит очищенную ДНК, пробы готовы к постановке ПЦР.
Очищенную ДНК можно хранить в течение недели при 2-8 оС и в течение 1 года при минус 20 оС. Эффективность выделения ДНК составляет 50-70 %.
Задание 1.1. Выделить ДНК из листьев комнатных растений. Задание 1.2. Выделить ДНК из полиэдров вируса ядерного полиэдроза непарного шелкопряда.
Занятие 2. Амплификация ДНК
Основой данного этапа ПЦР является программируемый амплификатор. Амплификатор в зависимости от стадии изменяет температурный режим пробирок и временной интервал. Амплификация ДНК включает в себя 3 стадии*: 1. денатурация ДНК (0,5-1 минута, 93 оС), 2. отжиг праймеров (0,5-1 минута, 35-40 оС), 3. наращивание цепи (1 минута, 72 оС). *Температура и продолжительность цикла подходят для праймеров типа OPA. Амплификация фрагмента определенной длины, который образуется при классическом отжиге праймера, изображенном на рис. 2, происходит по следующей математической формуле: F = 2(n-1) + 22(n-2) + 23(n-3) + 24(n-4) + 25(n-5) +... +2n-1 (a) , где n – количество циклов, F – количество одноцепочечных фрагментов в начале цикла n+1 (денатурация). Количество нарабатываемых двухцепочечных фрагментов описывается следующей математической формулой: F= 2 1(n-2) + 22(n-3) + 23(n-4) + 24(n-5) + 25(n-6) +... +2n-2 (b), где n- количество циклов, F-количество двухцепочечных фрагментов. Рассмотрим значения формулы b для каждого цикла: 1-й цикл – – 2-й цикл – 0 3-й цикл – 2n-4 4-й цикл – 6n-16 5-й цикл – 14n-48 и т. д. Каждое значение фрагментов для любого цикла можно представить в следующем виде: (2n-1-2)n – (2n-1-2)(n-2) – 2(n-2) = F, 2(2n-1-2) – 2(n-2) = F,
2(2n-1 - n) = F.
Количество ампликонов с каждым циклом(n) увеличивается почти в два раза. При n→ ∞ это можно записать в следующем виде:
lim 2n-1 – 2(n – 1)/ 2n – 2n = 1/2 n→ ∞ Для проведения данного этапа ПЦР (амплификации) используют разные приемы. Рассмотрим два из них. 1. «Горячий старт» («hot start») – прием, при котором пробирки с реагентами помещаются в амплификатор, нагретый до температуры 93-94 оС. Денатурация ДНК 1-го цикла должна протекать 2-2,5 минуты. Остальные циклы протекают согласно описанным выше температурным и временным константам. Данный прием позволяет избежать неспецифического отжига праймеров. Существуют разные модификации данного приема (например, с использованием воска). 2. Обычный прием предусматривает помещение пробирок в амплификатор при комнатной температуре. После достижения амплификатором температуры в 94 оС начинается процесс денатурации и т. д. Для проведения этапа амплификации ДНК используются стандартные наборы реактивов. Примером может служить набор «АмплиСенс – 200 -1» фирмы «АмплиСенс» (Москва, Россия). В его состав входят: 1. смесь нуклеотидтрифосфатов, 2 mM; 2. 5-кратный реакционный буфер, без Mg2+; 3. сульфат магния, 50 mM; 4. деионизованная вода, стерильная, автоклавированная; 5. Taq-полимераза, 5 ед/мкл; 6. воск для ПЦР, 14%-ный, плавление при 37 оС; 7. минеральное масло, вазелиновое; 8. исследуемая ДНК. Такой набор рассчитан на 200 реакций в объеме 25 мкл. Хранится набор при температуре 2-8 оС. Смешивание реактивов проводится в такой пропорции (возможны вариации):
1. смесь нуклеотидтрифосфатов – 2,5 мкл; 2. 5-кратный реакционный буфер – 5 мкл; 3. сульфат магния – 1,5 мкл; 4. деионизованная вода – 3 мкл; 5. Taq-полимераза – 0,5 мкл; 6. минеральное масло – 11,5 мкл; 7. исследуемая выделенная ДНК – 5мкл; 8. праймер – 1 мкл. Общий объем: 30 мкл. Амплификация ДНК длится приблизительно 2,5 – 3,5 часа (30-40 циклов). Количество праймера, необходимое для амплификации одного ДНК-фрагмента с одной молекулы ДНК в течение n циклов (рис. 2), описывается математической формулой: P=2n+1 – 2, где n - количество циклов, а Р - количество молекул праймера.
Порядок работы. 1. Промаркировать пробирки. 2. Смешать реактивы, исследуемую ДНК и праймер в пропорции описанной выше. Процентрифугировать на вортексе в течение 1 минуты, чтобы на стенках пробирок не осталось реагентов. 3. Выбрать подходящую программу на амплификаторе, загрузить пробирки в амплификатор и запустить амплификацию. 4. По окончанию амплификации можно приступать к 3-му этапу ПЦР (детекции продуктов амплификации). Пробирки с наработанными фрагментами ДНК можно хранить при температуре 2-8 оС в течение двух недель.
Задание 2.1. Провести амплификацию ДНК, выделенной из листьев комнатных растений с использованием праймеров серии OPA. Задание 2.2. Провести амплификацию ДНК, выделенной из полиэдров вируса ядерного полиэдроза непарного шелкопряда со специфическими праймерами: а) 5’- GCC GGC GGA ACT GGC CCA -3’, б) 5’- CGA CGT GGT GGC ACG GCG -3’.
|
||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 718; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.54.210 (0.007 с.) |