Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакция иммунофлуоресценции (РИФ)Содержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Впервые предложена Coombs в 1942 г. РИФ основана на выявлении антигенов в клиническом материале, препаратах клеток крови и др. с помощью моноклональных антител или сывороток, меченных флуорохромом (прямая РИФ). Первые (диагностические) антитела можно выявлять антииммуноглобулиновой сывороткой, меченной флуорохромами (непрямая РИФ). Существуют модификации РИФ для выявления антител к инфекционным агентам в сыворотке крови или антител в сыворотке крови. Популярность РИФ объясняется экономичностью, наличием широкого спектра диагностических наборов, быстротой получения ответа. Сегодня в этой реакции используются как поликлональные сыворотки, так и моноклональные антитела, меченные флюоресцеина изотиоцианатом (ФИТЦ). Для уменьшения неспецифического свечения фона применяют обработку препаратов бычьим сывороточным альбумином, меченным родамином или синькой Эванса. Чаще всего РИФ используют для быстрого обнаружения возбудителя в патологическом материале. В этом случае из исследуемого материала готовят мазок на предметном стекле, как для обычной микроскопии. Препарат фиксируют метиловым спиртом, ацетоном или другим химическим фиксатором. На поверхность фиксированного мазка наносят меченные ФИТЦ сыворотки или моноклональые антитела (в случае непрямой РИФ препарат сначала обрабатывают сывороткой против искомого антигена, а затем мечеными антителами к иммуноглобулинам, использованным на первом этапе). Поскольку РИФ является разновидностью гетерогенного анализа, один этап отделяется от другого промывкой. Учет результатов реакции осуществляется с помощью люминесцентного микроскопа, в оптическую систему которого устанавливается набор светофильтров, обеспечивающих освещение препарата ультрафиолетовым или сине-фиолетовым светом с заданной длинной волны. Исследователь оценивает характер свечения, форму, размер объектов и их взаимное расположение. При постановке РИФ для обнаружения антител готовят мазки из эталонного штамма возбудителя. Исследуемую сыворотку наносят на мазок. Если в ней присутствуют искомые антитела, то они связываются с антигенами микробных клеток. Промывка препарата буферным раствором позволяет удалить несвязавшиеся антитела. Затем препарат обрабатывают меченой сывороткой против иммуноглобулинов человека. В случае положительного результата реакции при микроскопии мазка в люминесцентном микроскопе наблюдают специфическое свечение эталонной культуры. Основным недостатком РИФ является ее субъективность. Классическими критериями специфичности этой реакции являются: · характерная морфология, размеры и расположение возбудителя в мазке; · периферический характер свечения объекта; · цвет флюоресценции; · интенсивность флюоресценции. При исследовании крупных объектов (трихомонады, клетки человека, клетки пораженные бактериями или вирусами) эти критерии позволяют получить достоверный результат. В то же время, элементарные тельца хламидий и микоплазмы имеют размеры, лежащие на пределе разрешающей способности люминесцентного микроскопа. При этом оценка морфологии микроорганизмов затруднена, а свечение теряет периферический характер. Остающихся критериев явно недостаточно для уверенной идентификации наблюдаемого микроорганизма. В связи с вышесказанным, субъективный характер учета реакции предъявляет особые требования к квалификации персонала, проводящего исследования. 2.2. Флуоресцентный иммуноанализ с временным разрешением (ФИА ВР, Etkins R. et Wallac O., 1984) Эта разновидность ФИА основана на принципах сорбции одного из реагентов на твердой фазе и применении технологии «сэндвича», т.е. двойного распознавания, подобно тИФА. Однако важным отличием метода является применение в качестве метки хелатов лантаноидов (редкоземельных элементов европия, самария, тербия и диспрозия). Преимущества ФИА ВР – это высокая чувствительность, технология постановки, подобная ИФА, и потенциальная возможность значительного усиления полезного сигнала вследствие весьма высокого отношения сигнал/шум. Специфическая флуоресцентная метка флуоресцирует неизмеримо сильнее и дольше, чем фоновая флуоресценция. Кроме того, метка обладает способностью восстанавливать способность к свечению (для учета применяют импульсное возбуждающее излучение с периодом в 1с - более 1000 импульсов), что приводит к накоплению (усилению) полезного сигнала. Описываемая система реализована фирмой PerkinElmer, США, под названием Delfia и обладает чувствительностью более 10-17 М при определении антигенов.
2.3. Проточная цитофлуориметрия
При измерении указанных свойств происходит анализ и распределение клеток по соответствующим признакам.
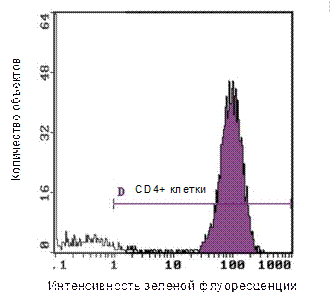
Важнейшие области применения цитофлуориметрии: · онкогематология (определение происхождения и степени дифференцировки опухолей крови); · трансплантация (аутотрансплантация) красного костного мозга и стволовых клеток; · клиническая иммунология (морфо-функциональный анализ состояния иммунокомпетентных клеток (ИКК) организма человека; · научные исследования; · другие задачи, требующие анализа частиц в суспензии (микробиология, цитология и др.). Проведение анализа ИКК на проточном цитофлуориметре. Для исследования ИКК крови их следует отделить от эритроцитов (методом градиентного центрифугирования или лизиса эритроцитов) и окрасить антителами против нужных CD антигенов. Анализ клеток по показателям прямого и бокового светорассеяния дает следующее нормальное распределение (рис 5):
Рисунок 5. Рапределение объектов в зависимости от размеров и внутренней структуры. Возможности метода в полном объеме раскрываются при окрашивании клеток мечеными моноклональными антителами против соответствующих CD-антигенов (рис 6, 7):
|
||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 410; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.134.195 (0.011 с.) |

 Рисунок 4. Схема цитофлуориметрии
Рисунок 4. Схема цитофлуориметрии