Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кафедра микробиологии, вирусологии, иммунологииСодержание книги Поиск на нашем сайте
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КАФЕДРА МИКРОБИОЛОГИИ, ВИРУСОЛОГИИ, ИММУНОЛОГИИ Д.А. Черношей, Т.А. Канашкова Методы иммуноанализа, основанные на применении меченых компонентов Учебно-методическое пособие Минск 2007 УДК ББК К14 Утверждено Научно-методическим советом университета в качестве учебно-методического пособия 31.01.2007, протокол № 5. Авторы: канд. мед. наук., доцент каф. микробиологии, вирусологии, иммунологии Черношей Д.А., канд. мед. наук, доцент Канашкова Т.А.; Рецензенты: Директор ГУ РНПЦГТ, д-р мед. наук, профессор Потапнев М.П., зав. каф. общ. хим., д-р биол. наук, профессор Барковский Е.В.
Методы иммуноанализа, основанные на применении меченых компонентов: Учеб.-метод. пособие/ Д.А.Черношей, Т.А. Канашкова. -Мн.: БГМУ, 2007. - с. ISBN Отражены вопросы классификации, характеристики, схем постановки, применения существующих методов иммуноанализа. Учебно-методическое пособие предназначено для студентов 2 курса всех факультетов. УДК ББК
Список сокращений
Введение Настоящий материал посвящен современным методам иммуноанализа, основанным на применении высокоактивной и специфичной метки - маркера, позволяющего непосредственно обнаружить продукт иммунной реакции. Такие методы обладают высокой чувствительностью, специфичностью, требуют минимального количества биоматериала, позволяют получить количественные, объективные результаты, позволяют осуществлять скрининг или диагностику на ранних стадиях заболевания при минимальных изменениях в организме или объекте исследования. Эти методы явились результатом эволюции ранних методов иммуноанализа, в которых иммунная реакция обнаруживалась по визуальному изменению состояния реагентов (агглютинация, преципитация, пассивная агглютинация), либо по характерному изменению биообъектов, добавляемых к реакционной смеси для выявления протекания реакции (РСК). Ситуация изменилась в 50-ых годах прошлого столетия (рисунок 1) после разработки и публикации метода определения инсулина (Berson S.A. et Yalow R.S.), основанного на конкурентном радиоиммунном анализе (РИА). Вскоре (В 60-ых годах) были разработаны принципы применения меченных изотопами антител для иммуноанализа, «сэндвич»- и твердофазный радиоиммуноанализ (радиоаллергосорбентный тест (РАСТ, Wide L.); иммунорадиометрический анализ (ИРМА, Mile L., Hales C.N.)). Немного позже был предложен иммуноферментный анализ (ИФА, Engvall E., Perlmann P., Rubinstein K и др.).
Рисунок 1. Развитие методов иммуноанализа Мощный импульс развитию иммуноанализа дала разработка технологии получения моноклональных антител (Milstein С.), после чего стало возможным полномасштабное развитие методов с применением ферментных, флуоресцентных и других меток (флуоресцентный иммуноанализ (ФИА, Etkins К., Wallac О.), хемолюминисцентный иммуноанализ (ХИА), гибридизация, технологии иммуносенсоров (ИС) и микроэрея (МЭ)).
В целом, эволюция иммуноанализа последние 50 лет идет в следующих направлениях: · повышение чувствительности и специфичности: · применение моноклональных антител; · применение рекомбинантных антител; · применение рекомбинантных и синтетических антигенов; · применение fusion-белков (рекомбинантные белки, продукты слияния различных генов для придания молекулам желаемых свойств: специфичности, структуры, биохимической или рецепторной активности); · применение аптомеров (одноцепочечный олигонуклеотид, проектируемый для специфического связывания с белками или другими нуклеиновыми кислотами); · разработка методов с повышенным сотношением сигнал/шум: · твердофазный ИФА в «сэндвич»-модификации, ФИА с временным разрешением, электрохемолюминесцентный иммуноанализ (ЭХИА); · упрощение и ускорение анализа: · отказ от конкурентного анализа в пользу неконкурентного; · отказ от радиоизотопных меток в пользу ферментных или флуоресцентных (хемолюминесцентных); · создания ускоренных методов иммуноанализа, не требующих специального оборудования и навыков (иммунохроматография (ИХА), дот-ИФА, и др.); · создания наборов для одновременного исследования нескольких параметров; · миниатюризация анализа: · уменьшение размеров устройств; · сокращение количества образца, необходимого для анализа; · сокращение количества реагентов, необходимых для анализа.
Радиоиммунный анализ (РИА) РИА разработан в 50-х годах прошлого века Yalow R.S. и Berson S.A. (определение инсулина). РИА (рис. 2.) основан на конкуренции определяемого антигена из клинического материала с определенным количеством идентичного, меченного изотопом, антигена с ограниченным количеством антител. Связанные антигены отделяются от свободных добавлением антиглобулиновой сыворотки, белка А стафилококков или микробус, меченных антителами к иммуноглобулинам, и центрифугированием. Супернатанты отбрасываются, а остаточная радиоактивность измеряется на гамма-счетчике. При указанной схеме постановки радиоактивность обратно пропорциональна содержанию антигена в образце.
Таким образом, РИА является конкурентным гетерогенным методом исследования. Основными преимуществами РИА является высокая чувствительность и специфичность. Применение изотопной метки и мечение антигена обеспечивают высокий уровень соотношения сигнал/шум и низкое неспецифическое связывание метки. Разработан также твердофазный РИА (разделение связавшихся и свободных антигенов достигается простой промывкой флаконов/планшет). Иммунорадиометрический анализ (ИРМА) Определение антител с помощью изотопной метки получило название иммунорадиометрического анализа. В качестве примера ИРМА рассмотрим радиоаллергосорбентный тест (РАСТ). РАСТ (рис. 3.) был разработан в начале 1970-х (Wide L.) для определения аллерген-специфических IgE в сыворотке крови. Аллерген сорбировали на пористом носителе (бумага, полимерные мембраны, гранулы, губки). Далее добавляли сыворотку пациента, инкубировали 3 часа, отмывали и добавляли антиглобулиновую сыворотку (против IgE), меченную радиоактивным изотопом. После отмывки несвязавшихся реагентов, радиоактивность учитывали на счетчике.
Рисунок 3. Схема радиоаллергосорбентного теста Первые тесты характеризовались низкой чувствительностью, плохо коррелировали с клиникой и другими аллергологическими тестами (прик-тесты) и не нашли широкого применения. В конце 70-х были предложены РАСТ второго поколения (большая чувствительность за счет меньшей специфичности и большей продолжительности теста; тесты по-прежнему носили качественный характер). Наконец, в 80-х – 90-х годах распространились РАСТ третьего поколения (большая чувствительность и специфичность за счет применения моноклональных антител против IgE, автоматизации, использования флуорохромных, ферментных меток или электрохемолюминисценции; применение IgE стандартов ВОЗ позволило получать количественные результаты). В целом, применение изотопных меток (РИА, ИРМА) сыграло важную роль в становлении иммуноанализа. Именно эти методы впервые раскрыли потенциал иммуноанализа и дали толчок к его разработке и коммерческому применению. Тем не менее, недостатки данного подхода (в первую очередь небезопасность, трудности разработки, транспортировки, хранения, утилизации отходов, необходимость применения дорогостоящего оборудования и др.) привели к вытеснению методов, основанных на радиоактивной метке, альтернативными. Иммуноферментный анализ (ИФА) ИФА, как и другие системы иммуноанализа, основан на специфическом распознавании и взаимодействии антигенов и антител. Процесс образования иммунных комплексов носит равновесный характер и зависит от аффинности компонентов, их концентрации и других условий реакции. Для оценки их количества возможно прямое определение концентрации образующихся иммунокомплексов, либо измерение оставшихся свободными мест специфического связывания. Второй общей стадией любого метода ИФА является формирование связи меченного ферментом соединения со специфическим комплексом или свободными центрами связывания. И наконец, заключительным обязательным процессом в ИФА является трансформация ферментной метки в соответствующий сигнал, измеряемый каким-либо физико-химическим методом (спектрофотометрическим, флуориметрическим и т.д.), что достигается путем измерения скорости превращения субстрата или количества продукта, образующегося за фиксированный промежуток времени. Основные достоинства ИФА, обеспечившие широкую распространенность метода: · высокая чувствительность, позволяющая выявлять концентрации антигена до 10 пг/мл; · высокая стандартность и воспроизводимость; · возможность использовать минимальные объемы исследуемого материала; · стабильность при хранении всех ингредиентов, необходимых для проведения ИФА (до года и более); · простота проведения реакции; · наличие как инструментального (в качественном и количественном варианте), так и визуального учета; · возможность автоматизации всех этапов реакции; · относительно низкая стоимость диагностических наборов и оборудования. Применение ИФА: · диагностика инфекционных заболеваний: · обнаружение антигенов возбудителя; · обнаружение антител к антигенам возбудителя; · мониторинг заболевания, определение ответа на терапию, прогноза развития заболевания и его исхода; · контроль поствакцинального иммунитета; · диагностика аутоиммунных заболеваний: · определение аутоантител; · диагностика аллергических заболеваний: · определение общего и специфического IgE; · определение продуктов активированных эозинофилов, базофилов и тучных клеток; · диагностика злокачественных опухолей: · определение в сыворотке маркеров опухолевого роста; · фенотипирование опухолевых клеток (тканей) для уточнения происхождения и дифференцировки опухоли; · определение концентрации гормонов, параметров менструально-овуляторного цикла; · диагностика беременности; · определение концентрации лекарственных препаратов; · определение допинга; · определение загрязнения окружающей среды; · и многое другое. В зависимости от подхода к измерению результата реакции выделяют неконкурентный и конкурентный ИФА. Если на первой стадии в системе присутствует только определяемый реагент: антиген или антитела, то метод является неконкурентным. Если на первой стадии анализа в системе одновременно присутствуют анализируемое соединение и его аналог (меченное ферментом анализируемое соединение или анализируемое соединение, иммобилизованное на твердой фазе), конкурирующие за имеющиеся центры специфического связывания, то метод является конкурентным. Выделяют также гомогенный и гетерогенный ИФА. Элиспот (ELIspot), ЭС ЭС – метод определения клеток, секретирующих определенные продукты (цитокины, антитела, медиаторы и др.). ЭС основан на тИФА по принципу «сэндвича», однако специфический продукт, секретируемый клетками, захватывается и определяется в месте секреции. Таким образом удается избежать его разведения в культуральной жидкости, ферментации клеточными протеазами, потребления клетками культуры, связывания с клеточными или растворимыми рецепторами. После удаления культуры захваченный продукт визуализируется вторыми моноклональными антителами к другому эпитопу продукта, меченными ферментом. После добавления субстрата в местах секреции продукта появляется окрашивание (в виде пятен/точек по принципу: одна специфическая клетка-продуцент – одно пятно). Результат выражается в количестве (проценте) клеток-продуцентов. Несмотря на то, что оба метода основаны на тИФА, они имеют существенные отличия (см. табл. 2). ЭС применяется для определения секреции цитокинов, антител, биоактивных веществ и медиаторов с целью определения функционального состояния иммунных клеток (цитокиновый профиль, поляризация иммунного ответа Th1-Th2-Th3, функция клеток-регуляторов), секреции специфических и общих IgE и др. для диагностики, мониторинга и контроля терапии аллергии, аутоиммунных заболеваний, трансплантационного иммунного ответа, противоопухолевого иммунитета и т.д. Следует отметить, что ЭС к настоящему времени не нашел широкого применения из-за относительной сложности и дороговизны соответствующих тест-систем. Таблица 2. Отличия тИФА и Элиспот
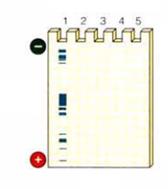
Иммуноблот ИБ (вестернблот) ИБ – метод, позволяющий одновременно выявлять специфические антитела к спектру антигенов (к каждому из них) в сыворотке или другом материале. ИБ основан на тИФА; в отличие от тИФА в планшетах обладает большей специфичностью (но меньшей чувствительностью). Этапы постановки ИБ (рис. 11): 1. Подготовка антигенов: · лизис/дезинтеграция вирусов, бактерий; · обработка додецил сульфатом натрия (SDS) для придания всем компонентам схожего соотношения отрицательный заряд/молекулярная масса. 2. Получение блотов: · разгонка антигенов в электрофорезе (пропорционально размеру); · перенос антигенов на мембрану; · разрезание мембраны на блоты (полоски, содержащие спектр антигенов). 3. Проведение реакции: · обработка блота сывороткой больного (специфические антитела больного связываются с соответствующими антигенами); · выявление связавшихся антител антивидовыми антителами к иммуноглобулинам человека, меченными ферментом; · внесение субстрата и проявление блотов (при связывании специфических антител в месте связывания образуется пятно); · учет реакции (сравнение результата с положительным и отрицательным контролями) и выдача заключения. ИБ применяют для: · подтверждения результатов других серологических реакций; · идентификации бактериальных или вирусных белков; · идентификации микробов; · научных целей.
Рисунок 11. Схема проведения иммуноблоттинга Люминесцентный иммуноанализ (ЛИА) ЛИА развивается с 70-х годов, когда была показана возможность использования люминесценции для определения антигенов и антител. В настоящее время к ЛИА относят методы, основанные на применении явления люминесценции для обнаружения продуктов реакции антиген-антитело. При этом меткой может быть какой-либо из компонентов био- или хемолюминесцентной реакции (кофакторы, катализаторы, ферменты, субстраты и т.д.). Реакции люминесценции относят к окислительно-восстановительным процессам, в ходе которых образуются нестабильные короткоживущие вещества, пребывающие в электронно-возбужденном состоянии. При переходе в основное (стабильное) состояние происходит излучение света в определенном диапазоне, который легко зарегистрировать с помощью фотоумножителей, фотоприемников и других устройств. Общая схема реакции: АГ + АТ-Люминофор = АГ-АТ-Люминофор + hν(фотон) К преимуществам ЛИА относят: · автономность (нет неоходимости во внешних источниках возбуждения свечения, что значительно упрощает проведение анализа); · широкий динамический диапазон; · возможность получения количественных достоверных результатов; · высокое отношение полезного/фонового сигналов · высокую чувствительность. Методы ЛИА делят на биолюминесценцию и хемолюминесценцию 4.1. Биолюминесцентный иммуноанализ: в реакционную систему входят кофакторы (АТФ или NAD), субстрат (люциферин) и фермент (люциферазы светляков или бактерий)).Таким образом, возможны следующие разновидности ИА: · люминесцентный иммунокофакторный анализ (ЛИКА). В качестве метки используются кофакторы (АТФ, NAD); · люминесцентный иммуноферментный анализ (ЛИФА) – в качестве метки применяют ферменты: люциферазы или генераторы кофакторов (пируваткиназу или глюкозо-6-фосфат дегидрогеназу). В целом, методы биолюминесцентного анализа характеризуются высокой чувствительностью (до 0,5 нМ антигена) и весьма перспективны для разработки высокоэффективных гомогенных методов ИА (хотя существуют и гетерогенные, в т.ч. твердофазные модификации). Среди недостатков – высокая стоимость препаратов ферментов, необходимость устранения кофакторов и примесей из биологических материалов. 4.2. Хемолюминесцентный иммуноанализ: в реакционную систему входят субстрат, окислитель, фермент-катализатор. Таким образом, различают: · хемолюминесцентный иммуноферментный анализ (ХИФА). В качестве метки используют фермент-катализатор (пероксидаза, микропероксидаза (фрагмент цитохрома С)). В настоящее время наибольшее распространение получил ХИФА с двумя субстратами (люминол+люциферин) и пероксидазой в качестве метки. Чувствительность метода оценивается в 10-13 М антигена; время анализа – 30 минут; · хемолюминесцентный субстратный анализ (ХИСА). В качестве метки применяют молекулы субстрата (изолюминол, эфиры акридина). Метод обладает высокой чувствительностью (10-12 М или до 0,2 пг антигена для изолюминола, до 10-18 М антигена для эфиров акридина). · хемолюминесцентный иммуноанализ с использованием переноса энергии рассмотрим на примере э лектрохемолюминисцентного анализа (ЭХИА). Метод ЭХИА основан на принципах твердофазного иммуноанализа (технология «сэндвича») с применением электрохемолюминесцентной метки. Одна из коммерчески доступных систем – «ORIGEN», США, - основана на применении магнитных микробус, покрытых моноклональными антителами к искомому антигену, и детектирующих антител, коньюгированных с хелатом рутения. Подобные метки обладают малым молекулярным размером, легко присоединяются к белковым реагентам и не нарушают их иммунных, биохимических и агрегатных свойств. Типичный анализ проводится по следующей схеме: материал, содержащий искомый антиген, смешивается с магнитными микробусами, покрытыми антителами против антигена, и детектирующими антителами, коньюгированными с меткой. После короткой инкубации анализатор перемещает реакционую смесь в специальную камеру, где происходит захват микробус с помощью магнита, их промывка от несвязавшихся реагентов и измерение люминесценции. Измерительное устройство включает фотометр и электрод с магнитом. Магнит захватывает микробусы, связавшие антиген и специфическую метку, после чего на электрод подается потенциал (1,5 В), который обеспечивает быстрый обмен электронами между субстратом (трипропиламин) и атомами рутения. Это приводит к люминисценции метки, которая измеряется фотометрически. Измерение можно проводить многократно, поскольку испускание фотона регенерирует метку. Кроме того, реакция происходит в турбулентном потоке микробус в камере, что обеспечивает равномерное смешивание реагирующих компонентов и быстрое протекание реакции (в отличие от ИФА или РИФ, где захват антигена происходит на плоскости и имеет пространственные ограничения). Заявленная чувствительность при определении антигена составляет до 0,2 10-12Моль антигена, а динамический диапазон линейной области реакции - шесть порядков. Системы на основе ЭХИА выпускают также фирмы Roche Diagnostics (Elecsys), Organon Teknika (NucliSens), PerkinElmer (QPCR System5000).
Иммуносенсоры (ИС) ИС – это устройства, состоящие из специфического антигена/ антитела (датчик), связанного с преобразователем и передатчиком сигнала о связывании соответствующего лиганда (рис.13).
Рисунок 13. Блок-схема работы иммуносенсоров
Непрямые ИС – основаны на использовании меченых компонентов для обнаружения связывания (флуоресценция, хемолюминесценция). Прямые ИС обнаруживают связывание по переносу электронов, выделению или поглощению газов, разности потенциалов, сопротивления, массы, температуры или изменению оптических свойств и т.д. Прямые ИС можно применять для отслеживания реакции антиген – антитело в режиме реального времени. Потенциально данный подход позволяет определять широкий спектр веществ в концентрации от 10-9 – 10-13 М/л и выше. Основные преимущества ИС: · отсутствие необходимости в применении меченых лигандов; · возможность многократного использования; · возможность мониторирования (получения результатов в реальном времени); высокая чувствительность и специфичность · технологичность и возможность массового производства. В настоящее время ИС считаются перспективным направлением иммуноанализа, однако на практике существует весьма ограниченное количество коммерческих тест-систем.
Микроэррей (МЭ) МЭ (microarrey) является сравнительно новым (разработан в 1990-х годах) и весьма перспективным направлением в прикладной молекулярной биологии. В настоящее время наибольшее распространение получила технология микроэррея, основанная на ДНК-олигонуклеотидах, однако развивается и микроэррей с применением моноклональных антител и рекомбинантных антигенов. В частности, подобная технология применяется для диагностики и оптимизации лечения аллергий (рис. 14).  Рисунок 14. Схема проведения микроэрея для диагностики аллергии. Рисунок 14. Схема проведения микроэрея для диагностики аллергии.
1. Приготовление микрочипа: раскапывание рекомбинантных аллергенов на поверхность активированного предметного стекла (объем капли - нанолитры, количество антигена - десятки пикограмм). Одно стекло содержит 12 ячеек. Каждая ячейка содержит десятки (сотни) различных аллергенов и калибровочную кривую (возрастающие количества IgE) в триплетах. Таким образом, одновременно можно обследовать до 12 пациентов. 2-3. Ход теста: · раскапывание сывороток пациентов (15 мкл); · инкубация (IgE пациента соединяются с аллергенами) · добавление моноклональных антител против IgE, меченных флуорохромом; · сканирование микрочипа: · типичная сканограмма микрочипа: · первые три ряда = калибровочная кривая (интенсивность свечения пропорциональна количеству фиксированных IgE); · далее профиль сенсибилизации пациента (специфичность и количество IgE в сыворотке пациента).
Аналогичные микроэрреи применяются для обнаружения и исследования аутоантител против различных компонентов (антигенов) соединительной ткани при системных аутоиммунных заболеваниях (ревматоидный артрит, системная красная волчанка и др.). Обратная техника (фиксация набора моноклональных антител на стекле) используется для анализа белков, полисахаридов, биологически активных соединений, медикаментов, токсинов и др. в составе клинических образцов, причем можно анализировать не только растворы, но и суспензии клеток (точная диагностика (фенотипирование) лейкозов).
Иммунохроматографический анализ (ИХА) ИХА (предложен в начале 1980-х гг.) можно отнести к группе реакций с мечеными антителами. В качестве метки используют окрашенный латекс или частицы коллоидного золота. Типичный тест представляет собой пластиковую пластинку и содержит окно для внесения материала, окно для учета результата и одно или несколько окон для внутреннего контроля/контролей (рис. 15).
В реакции используют: · первые антитела к искомому антигену, иммобилизованные в виде полосы на хроматографическом носителе в окне для учета результата (выше окна для внесения материала); · вторые антитела к тому же антигену, адсорбированные на микрочастицах золота или латекса (размещаются в окне для внесения материала). Внутренний контроль/контроли включают: · выявляемый антиген, нанесенный после окна для учета результата (положительный контроль, контроль протекания всех этапов основной реакции); · антивидовые антитела против вторых (меченых) антител, закрепленные в виде полосы на носителе (отрицательный контроль, контроль переноса ингредиентов по носителю, адекватность внесения материала); · неспецифические первые антитела (того же происхождения) (контроль специфичности связывания вторых антител). Постановка теста на примере системы для диагностики инфекционного мононуклеоза (рис. 16): Подготовленный исследуемый материал в небольшом количестве (5-7 капель) вносится в стартовое окно тест-системы. Здесь происходит взаимодействие антигена с антителами, адсорбированными на частицах, и начинается движение образовавшихся комплексов за счет капиллярности носителя. Дойдя до антител, расположенных на носителе в окне учета результата, эти комплексы связываются, при этом частицы латекса или коллоидного золота проявляются в виде линии голубого (латекс) или (коричневого) цвета. Поскольку частицы, нагруженные, антителами берутся в избытке, часть их движется дальше и связывается в окне (окнах) внутреннего контроля реакции. Полоса в этом окне свидетельствует о правильной работе тест-системы.
В настоящее время разработаны тест-системы для установления овуляции и беременности, выявления стрептококков группы А в мазках из зева, вирусов грипа А и В и РС-вируса в соскобах и смывах из носоглотки, возбудителей туберкулеза в мокроте, хламидий в соскобах из уретры и шейки матки, токсина C.dificile в испражнениях, вируса Эпштейн-Барр в крови, определения маркеров повреждения миокарда (инфаркт миокарда), патологического свертывания крови (тромбоз), нарушения обмена кальция (остеопороз) и др. ИХА может использоваться как для экспресс-индикации антигенов в пробе, так и для идентификации выделенных культур. Например, ИХА позволяет проводить обнаружение листерий в исследуемом материале непосредственно в среде обогащения, без выделения чистой культуры. Это позволяет сократить время исследования до 48 часов. Таким образом, ИХА тест-системы обладают несомненными достоинствами: · высокой специфичностью, · скоростью получения результата, · доступны, легко интерпретируются, · не требуют медицинской или лабораторной квалификации, · могут применяться пациентами самостоятельно в любых условиях. Однако по чувствительности ИХА системы уступают другим методам иммуноанализа, что позволяет применять их лишь в качестве ориентировочного теста. Существует также проблема документирования результатов и ряд этических проблем, связанных с самостоятельным применением тестов пациентами.
Список литературы Антитела. Методы. В 2-х кн. Кн. 2: Пер. с англ./Под ред. Д.Кэтти. – М.: Мир, 1991. – 384 с. Иммуноферментный анализ: Пер. с англ./Под ред. Т. Нго и Г. Ленхоффа.- М.: Мир, 1988. – 446 с. Манолов А. Твердофазные радиоиммунные методы для количественного экспресс-анализа в микробиологии //ЖМЭИ, 1985, N:4, с.100-107. Теория и практика иммуноферментного анализа/ А.М. Егоров, А.П. Осипов, Б.Б. Дзантиев, Е.М. Гаврилова – М.: Высш. шк., 1991. – 288 с. Тертон М., Бангхем Д.Р., Колкотт К.А. и др. Новые методы иммуноанализа: Пер с англ. – М.: Мир, 1991. – 280 с. Birjis Chinoy, Edgar Yee, Sami L Bahna Skin testing versus radioallergosorbent testing for indoor allergens//Clinical and Molecular Allergy2005, 3:4. C. Harwanegg, R. Hiller Protein microarrays for the diagnosis of allergic diseases: State-of-the-art and future development// J Lab Med 2005, 29(4): 272–277. C. L. Morgan, D. J. Newman, C. P. Price Immunosensors: technology and opportunities in laboratory medicine//Clinical Chemistry 1996,42:2.- P.193-209. Clinical chemistry, 1990,36/8, 1408-1427. Immunoassay of infectious agents/ P. E. Andreotti, G. V. Ludwig, A. H. Peruski //BioTechniques 2003,35: P. 850-859. J. P. GoslIng A Decade of Development in Immunoassay Methodology// Clinical Chemistry, 1990, Vol.36, No. 8, P. 1408. L. J. Kricka Miniaturization of analytical systems//Clinical Chemistry, 1998,44:9, P. 2008–2014. L. J. Kricka Selected Strategies for Improving Sensitivity and Reliability of Immunoassays//Clinical chemistry, 1994, 40/3, P. 347-357. Immunochemical staining methods / S.J.Naish, T.Boenisch, A.J.Farmilo, R.H.Stead//DAKO Corporation, Carpinteria, California, 1989. – P.41. Methods of Biomaterials Testing // http:\\www.manfred.maitz-online.de Microarrayed recombinant allergens for diagnostics of allergy/Harwanegg C., Laffer S., Hiller R et al. //Clin. Exp. Allergy 2003, 33: 7- 13. R Spiewak ELISpot: Principles of the technique//www.ELISpot.biz R. P. Ekins Ligand assays: from electrophoresis to miniaturized microarrays//Clinical Chemistry, 1998; 44: 2015-2030. Radioallergosorbent Test (RAST) Methods for Allergen-Specific Immunoglobulin E (IgE) 510(k)s; Final Guidance for Industry and FDA / U.S. Department of Health and Human Services Food and Drug Administration;Center for Devices and Radiological Health.- August 22, 2001. Radioimmunometric Assay for a Monoclonal Antibody-Defined Tumor Marker, CA 19-9/ Villano B. C., Brennan S., Bucher C. et al.// Clinical Chemistry,1983, Vol. 29, No. 3, 1983 549
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 834; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.102.138 (0.015 с.) |


 Рисунок 2. Схема радиоиммунного анализа
Рисунок 2. Схема радиоиммунного анализа