
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Закономерности кристаллизации металловСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Любое вещество может находиться в трех агрегатных состояниях: твердом, жидком, газообразном.
Изменение свободной энергии в зависимости от температуры
Кристаллизация – это процесс образования участков кристаллической решетки в жидкой фазе и рост кристаллов из образовавшихся центров. Кристаллизация протекает в условиях, когда система переходит к термодинамически более устойчивому состоянию с минимумом свободной энергии. При соответствующем понижении температуры в жидком металле начинают образовываться кристаллики – центры кристаллизации или зародыши. Для начала их роста необходимо уменьшение свободной энергии металла, в противном случае зародыш растворяется. Минимальный размер способного к росту зародыша называется критическим размером, а зародыш – устойчивым. Переход из жидкого состояния в кристаллическое требует затраты энергии на образование поверхности раздела жидкость – кристалл. Процесс кристаллизации будет осуществляться, когда выигрыш от перехода в твердое состояние больше потери энергии на образование поверхности раздела. Зародыши с размерами равными и большими критического растут с уменьшением энергии и поэтому способны к существованию. Свободная энергия – составляющая полной энергии, которая обратимо меняется с изменением температуры.
Зависимость энергии системы от размера зародыша твердой фазы Рост продолжается в направлениях, где есть свободный доступ питающей среды. После окончания кристаллизации имеем поликристаллическое тело. Размер зерен при кристаллизации зависит от числа частичек нерастворимых примесей, которые играют роль готовых центров кристаллизации- оксиды, нитриды, сульфиды. Чем больше частичек, тем мельче зерна закристаллизовавшегося вещества. Мелкозернистую структуру можно получить в результате модифицирования, добавлением в жидкие металлы посторонних веществ-модификаторов. По механизму воздействия модификаторов различают: А)вещества, не растворяющихся в жидком металле-выступают в качестве дополнительных центров кристализации; Б)поверхностно-активные вещества, которые растворяются в металле, и, осаждаюсь на поверхности растущих кристаллов, препятствуют их росту
7. Строение металлического сплава зависит от того, в какие взаимодействия вступают компоненты, составляющие сплав. Почти все металлы в жидком состоянии растворяются друг в друге в любых соотношениях. В зависимости от характера взаимодействия компонентов различают сплавы: 1. механические смеси; 2. химические соединения; 3. твердые растворы. Сплавы механические смеси образуются, когда компоненты не способны к взаимному растворению в твердом состоянии и не вступают в химическую реакцию с образованием соединения.
Сплавы химические соединения образуются между элементами, значительно различающимися по строению и свойствам, если сила взаимодействия между разнородными атомами больше, чем между однородными.
Кристаллическая решетка химического соединения Сплавы твердые растворы – это твердые фазы, в которых соотношения между компонентов могут изменяться. Являются кристаллическими веществами. Характерной особенностью твердых растворов является: наличие в их кристаллической решетке разнородных атомов, при сохранении типа решетки растворителя. Твердый раствор состоит из однородных зерен
По характеру распределения атомов растворенного вещества в кристаллической решетке растворителя различают твердые растворы: · замещения; · внедрения; · вычитания.
Рис.4.4. Кристаллическая решетка твердых растворов замещения (а), внедрения (б)
Внедрение – размещение атомов раствор вещ-ва в своб промежутках растворителя. Строение – зона столб кристаллов, зона равноосн крист. Система – группа тел, выбираемых для изучения или исследования. Компонент – вещ-ва, необходимые и достаточные для образования системы. Фаза – однородная часть системы, отделенная от неё другой частью системы, пов-тью раздела, при переходе ч-з которую хим состав или структура изменяются скачком.
8. Диаграмма состояния и её построение Правило фаз Фаза – однородная часть системы, отделенная от других частей системы поверхностного раздела, при переходе через которую структура и свойства резко меняются. Если вариантность C = 1 (моновариантная система), то возможно изменение одного из факторов в некоторых пределах, без изменения числа фаз. Если вариантность C = 0 (нонвариантная система), то внешние факторы изменять нельзя без изменения числа фаз в системе. Существует математическая связь между числом компонентов (К), числом фаз (Ф) и вариантностью системы (С). Это правило фаз или закон Гиббса
Если принять, что все превращения происходят при постоянном давлении, то число переменных уменьшится Диаграмма состояния представляет собой графическое изображение состояния любого сплава изучаемой системы в зависимости от концентрации и температуры . Диаграммы состояния показывают устойчивые состояния, т.е. состояния, которые при данных условиях обладают минимумом свободной энергии, и поэтому ее также называют диаграммой равновесия, так как она показывает, какие при данных условиях существуют равновесные фазы. Температуры, соответствующие фазовым превращениям, называют критическими точками. Некоторые критические точки имеют названия, например, точки отвечающие началу кристаллизации называют точками ликвидус, а концу кристаллизации – точками солидус. По диаграмме состояния можно определить температуры фазовых превращений, изменение фазового состава, приблизительно, свойства сплава, виды обработки, которые можно применять для сплава.
|
||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 2040; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.156 (0.009 с.) |


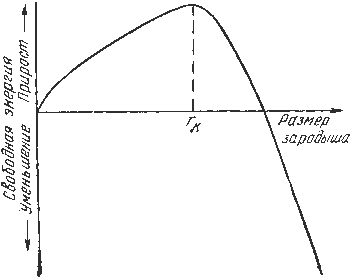
 Схема микроструктуры механической смеси
Схема микроструктуры механической смеси
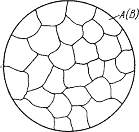 Схема микроструктуры твердого раствора
Схема микроструктуры твердого раствора В растворах замещения в кристаллической решетке растворителя часть его атомов замещена атомами растворенного элемента. Замещение осуществляется в случайных местах, поэтому такие растворы называют неупорядоченными твердыми растворами.
В растворах замещения в кристаллической решетке растворителя часть его атомов замещена атомами растворенного элемента. Замещение осуществляется в случайных местах, поэтому такие растворы называют неупорядоченными твердыми растворами.
 где: С – число степеней свободы, К – число компонентов, Ф – число фаз, 1 – учитывает возможность изменения температуры.
где: С – число степеней свободы, К – число компонентов, Ф – число фаз, 1 – учитывает возможность изменения температуры. Рис. 4.5. Диаграмма состояния
Рис. 4.5. Диаграмма состояния


