
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теоретические основы процесса кристаллизацииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Все вещества могут находиться в трех агрегатных состояниях:твердом, жидком и газообразном, переходы между которыми (так называемые фазовые переходы) сопровождаются скачкообразными изменениями свободной энергии энтропии, плотности и других физических свойств. Жидкости и твердые тела относят к конденсированному состоянию вещества. В отличие от газообразного состояния у вещества в конденсированном состоянии атомы расположены ближе друг к другу, что приводит к их более сильному взаимодействию и, как следствие этого, жидкости и твердые тела имеют постоянный собственный объем. Для теплового движения атомов в жидкости характерны малые колебания атомов вокруг равновесных положений и частые перескоки из одного равновесного положения в другое. Это приводит к наличию в жидкости только так называемого ближнего порядка в расположении атомов, т. е. некоторой закономерности в расположении соседних атомов на расстояниях, сравнимых с межатомными. Для жидкости в отличие от твердого тела характерно такое свойство, как текучесть. Атомы в твердом теле, для которого в отличие от жидкого тела характерна стабильная, постоянная собственная форма, совершают только малые колебания около своих равновесных положений. Это приводит к правильному чередованию атомов на одинаковых расстояниях для сколь угодно далеко удаленных атомов, т. е существования, так называемого дальнего порядкав расположении атомов. Такое правильное, регулярное расположение атомов в твердом теле, характеризующееся периодической повторяемостью в трех измерениях образует кристаллическую решетку, а тела, имеющие кристаллическую решетку, называют твердыми телами. Кроме того, существуют аморфные тела (стекло, воск и т. д.). В аморфных телах атомы совершают малые колебания вокруг хаотически расположенных равновесных положений, т. е. не образуют кристаллическую решетку. Аморфное тело находится с термодинамической точки зрения в неустойчивом (так называемом метастабильном) состоянии и его следует рассматривать как сильно загустевшую жидкость, которая с течением времени должна закристаллизоваться, т. е. атомы в твердом теле должны образовать кристаллическую решетку и превратиться в истинно твердое тело. Аморфное состояние образуется при быстром – (106оС/с и более) охлаждении расплава. Например, при охлаждении ряда сплавов из жидкого состояния образуются так называемые металлические стекла, обладающие специфическими физико–механическими свойствами. Атомы в кристаллическом твердом теле располагаются в пространстве закономерно, периодически повторяясь в трех измерениях через строго определенные расстояния, т. е. образуют кристаллическую решетку. Кристаллическую решетку можно «построить», выбрав для этого определенный «строительный блок» (аналогично постройке стены из кирпичей) и многократно смещая этот блок по трем, непараллельным направлениям. Такая «строительная» единица кристаллической решетки имеет форму параллелепипеда и называется элементарной ячейкой. Все элементарные ячейки, составляющие кристаллическую решетку, имеют одинаковую форму и объемы. Атомы могут располагаться как в вершинах элементарной ячейки, так и в других ее точках (в узлах кристаллической решетки). В первом случае элементарные ячейки называются простыми (примитивными), во втором – сложными. Если форма элементарной ячейки определена и известно расположение всех атомов внутри нее, то имеется полное геометрическое описание кристалла, т. е. известна его атомно-кристаллическая структура. При переходе из жидкого состояния в твердое образуется кристаллическая решетка, возникают кристаллы. Такой процесс называется кристаллизацией. Переход металла из жидкого или парообразного состояния в твердое с образованием кристаллической структуры называется первичной кристаллизацией. Образование новых кристаллов в твердом кристаллическом веществе называется вторичной кристаллизацией. Процесс кристаллизации слагается из двух одновременно идущих процессов: зарождения и роста кристаллов. Кристаллы могут зарождаться самопроизвольно (самопроизвольная кристаллизация) или расти на имеющихся готовых центрах кристаллизации (несамопроизвольная кристаллизация). В природе все самопроизвольно протекающие превращения, а, следовательно, кристаллизация и плавление обусловлены тем, что новое состояние в новых условиях является энергетически более устойчивым, обладает меньшим запасом энергии. Поясним примером. Тяжелый шарик из положения 1 (рис.1.6) стремится попасть в более устойчивое положение 2, так как потенциальная энергия в положении 2 меньше, чем в положении 1.
Рис.1.6. Пример самопроизвольной кристаллизации
Энергетическое состояние системы, имеющей огромное число охваченных тепловым движением частиц (атомов, молекул), характеризуется термодинамической функцией (потенциалом) Z(F), также называемой свободной энергией. Свободная энергия F(Z) = H - ТS, где Н – внутренняя энергия системы(энтальпия); Т–абсолютная температура; S–энтропия, равная энергии колебания элементарных частиц в узлах решетки (вибрационная составляющая) и энергии поступательного движения валентных электронов при тепловом возбуждении (электронная составляющая). Таким образом, чем больше свободная энергия системы, тем система менее устойчива, и если имеется возможность, то система переходит в состояние, где свободная энергия меньше («подобно» шарику, который скатывается из положения 1 в положение 2, если на пути нет препятствия). С изменением внешних условий, например температуры, свободная энергия системы изменяется по сложному закону, но различно для жидкого и кристаллического состояний. Схематически характер изменения свободной энергии жидкого и твердого состояний с температурой показан на рис. 1.7. Выше температуры Тs, меньшей свободной энергией обладает вещество в жидком состоянии, ниже Тs – вещество в твердом состоянии. Следовательно, выше Ts, вещество должно находиться в жидком состоянии, а ниже Тs, – в твердом, кристаллическом. Очевидно, что при температуре, равной Ts, свободные энергии жидкого и твердого состояний равны, металл в обоих состояниях находится в равновесии. Эта температура Ts и есть равновесная или теоретическая температура кристаллизации. Однако при Ts не может происходить процесс кристаллизации (плавление), так как при данной температуре F(Z)ж = Fкр и процесс кристаллизации (плавления) не может идти, так как при равенстве обеих фаз это не будет сопровождаться уменьшением свободной энергии.
Рис. 1.7. Изменение свободной энергии жидкого (1) и кристаллического (2) состояния в зависимости от температуры
Для начала кристаллизации необходимо, чтобы процесс был термодинамически выгоден системе и сопровождался уменьшением свободной энергии системы. Из кривых, приведенных на рис. 1.8 видно, что это возможно только тогда, когда жидкость будет охлаждена ниже точки Ts. Температура, при которой практически начинается кристаллизация, может быть названа фактической температурой кристаллизации. Так в металлических кристаллах плотноупакованные структуры ГПУ(К = 12) и ГЦК ( К = 12) имеют большую энергию связи и устойчивы при низких температурах (до Т1). Более «рыхлая» структура ОЦК (К =8) имеет большую энтропию, вследствие большей амплитуды колебаний атомов, а поэтому устойчива при повышенных температурах. Этим объясняется стабильность ОЦК решетки при повышенных температурах во многих металлах Ti, Zr, Hf, Fe. Стабильность ОЦК решетки в железе и при низких температурах связывают с возрастанием электронной составляющей энтропии. Стабильность модификаций может меняться в связи с изменением типа связи. При низких температурах благодаря большой энергии ковалентной связи стабильна модификация олова с решеткой алмаза Snα, которая при нагреве сменяется модификацией Snβ с более слабой металлической связью, но с большей энтропией. Разница между равновесной (Ts) и реальной (Тп) температурой кристаллизации называется степенью переохлаждения (D Т). Разница между реальными температурами плавления и кристаллизации называется температурным гистерезисом. Степень переохлаждения увеличивается с ростом скорости охлаждения.Обычная степень переохлаждения металлов при кристаллизации в производственных условиях колеблется от 10 до 30°С; при больших скоростях охлаждения она может достичь сотен градусов. Степень перегрева при плавлении металлов обычно не велика (не превышает нескольких градусов). При кристаллизации выделяется теплота. Когда кристаллизуется чистый элемент, отвод теплоты, происходящий вследствие охлаждения, компенсируется теплотой кристаллизации. Поэтому на кривой охлаждения, изображаемой в координатах «температура– время» процессу кристаллизации соответствует горизонтальный участок (кривая 1,рис. 1.8).
Рис. 1.8. Кривые охлаждения при кристаллизации
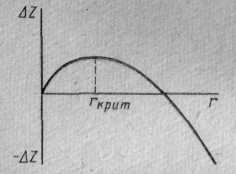
По окончании кристаллизации, т. е. после полного перехода в твердое состояние, температура снова начинает снижаться, и твердое кристаллическое вещество охлаждается. Теоретически процесс кристаллизации изображается кривой 1. Кривая 2 показывает реальный процесс кристаллизации. Жидкость непрерывно охлаждается до температуры переохлаждения Тп, лежащей ниже теоретической температуры кристаллизации Ts. При охлаждении ниже температуры Ts создаются энергетические условия, необходимые для протекания процесса кристаллизации.У некоторых металлов из–за большого переохлаждения скрытая теплота плавления выделяется в первый момент кристаллизации настолько бурно, что температура скачкообразно повышается, приближается к теоретической (кривая 3, рис.1.8). В жидком состоянии атомы вещества вследствие теплового движения перемещаются беспорядочно. В то же время в жидкости имеются сравнительно устойчивые группировки атомов небольшого объема. Эти группировки неустойчивы, рассасываются и вновь появляются в разных местах жидкости. В пределах группировки расположение атомов вещества во многом аналогично их расположению в решетке кристалла. При переохлаждении жидкости некоторые из них, наиболее крупные, становятся устойчивыми и способными к росту. Эти устойчивые группировки атомов называются центрами кристаллизации (зародышами). Появление центров изменяет термодинамический потенциал Z. С одной стороны, при переходе жидкости в кристаллическое состояние термодинамический потенциал уменьшается, с другой стороны, он увеличивается вследствие появления поверхности раздела между жидкостью и кристаллическим зародышем. Рост очень маленького зародыша увеличивает термодинамический потенциал системы «жидкость – зародыш», а рост сравнительно большого зародыша – его уменьшает (рис. 1.9). Для данной степени переохлаждения имеется некоторый зародыш критического размера гкр. Все зародыши большего размера будут центрами кристаллизации, а зародыши – меньшего размера окажутся неустойчивыми и вновь рассасываются в жидкости.
Центр кристаллизации, обрастая новыми слоями атомов, становится крупнее. Кристаллы растут свободно до тех пор, пока со всех сторон их окружает жидкость. Форма таких растущих кристаллов геометрически правильна и соответствует их кристаллическому строению. При взаимном столкновении граней кристаллов их правильная форма нарушается и становится в момент окончания процесса кристаллизации неправильной. Зародыши, возникающие в жидкой фазе, имеют трехмерные размеры и называются трехмерными. Рост зародыша происходит не путем присоединения к нему отдельных атомов, а путем наслоения на растущую грань атомной плоскости, толщиной не меньше критического зародыша. Зарождение центра критического размера требует определенной энергии, котораяпередается от атомов жидкости, имеющих избыточную энергию, выше некоторой средней. Дело в том, что энергия распределена неравномерно, имеются флуктуации энергии, т. е. часть атомов имеет избыточную энергию, а какая-то часть энергию меньше среднего уровня. В жидкости энергия непрерывно перераспределяется между атомами. Критический размер зародыша связан с термодинамическими параметрами
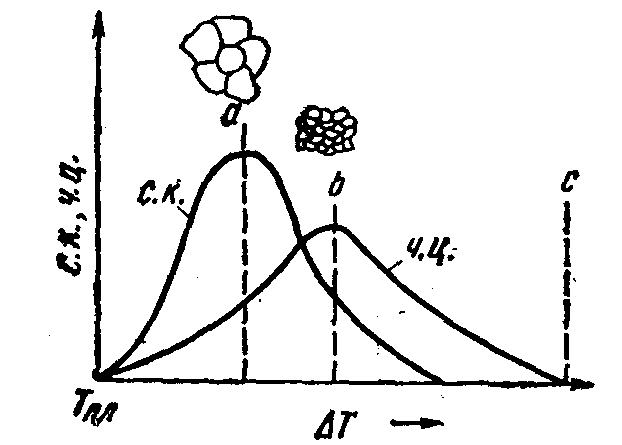
где σ – удельное (на 1 см2) поверхностное натяжение на границе жидкость – кристалл; Δf – удельное (на 1 см3) изменение свободной энергии при переходе жидкости в кристаллическое состояние. С увеличением степени переохлаждения поверхностное натяжение меняется незначительно, а Δf – быстро увеличивается. Следовательно,с ростом степени переохлаждения критический размер зародыша убывает, центров появляется больше. Таким образом, кристаллизация состоит из двух процессов. Первый из них заключается в зарождении мельчайших кристаллических частиц, называемых зародышами или центрами кристаллизации, второй – в росте кристаллов из этих центров. Скорость зарождения центров кристаллизации выражается числом зародышей, образующихся в единице объема жидкости за единицу времени. Оно обозначается (ч. ц.) – число центров. Скорость роста кристаллов или скорость кристаллизации выражается линейной скоростью движения кристаллов в направлении перпендикулярном к ней. Эта скорость обозначается (с. к.) – скорость кристаллизации или (с. р.) – скорость роста кристаллов, она измеряется единицами длины в единицу времени. На рис. 2 приведены кривые зависимости ч. ц. и с. р. от степени переохлаждения. С увеличениемD Т возрастает число центров кристаллизации и увеличивается скорость их роста; при определенной степени переохлаждения наступает максимум. Однако металлы и сплавы отличаются в жидком состоянии сравнительно малой способностью к переохлаждению, т.е. их невозможно переохладить до таких температур, при которых ч. ц. достигали бы максимума. Поэтому для металлов кривые обрываются уже при малых степенях переохлаждения (сплошные линии).
При малой степени переохлаждения, когда скорость образования центров кристаллизации мала, а скорость их роста велика, размеры кристаллов велики; при больших степенях переохлаждения скорость зарождения новых центров велика, а скорость роста мала: кристаллы получаются более мелкими. Фактический размер кристаллов определяется соотношением скоростей роста кристаллов и образования центров кристаллизации. Оба процесса связаны с перемещениями атомов, т. е. являются диффузионными и зависят от температуры. У некоторых веществ (органические соединения, стекла) при очень больших степенях переохлаждения диффузия замедляет и образование центров кристаллизации, и рост кристаллов. В ряде случаев сохраняется переохлажденное аморфное состояние. У металлов, как правило, реализуются лишь восходящие участки кривых и с ростом переохлаждения увеличиваются скорости обоих процессов. Однако скорость образования центров растет более резко и поэтому в металлах при увеличении степени переохлаждения получаются все более мелкие кристаллы. Соответственно при малых степенях переохлаждения велик критический размер зародыша, а скорость зарождения мала и кристаллы получаются крупными. При заливке жидкого металла в форму с низкой теплопроводностью (земляная, шамотная) или в подогретую металлическую форму кристаллизация идет при небольших степенях переохлаждения. Увеличение переохлаждения получается при заливке жидкого металла в холодные металлические формы Число зерен (кристаллов) n в единицу объема металла и их размер при данной степени переохлаждения, может быть определен по формуле:
Таким образом, изменяя степень переохлаждения, можно получить кристаллы (зерна) различной величины. От величины зерен зависят многие свойства металлов. Более желательно мелкозернистое строение.
|
||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 1139; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.37.212 (0.013 с.) |




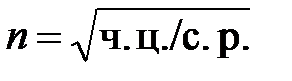 .
.


