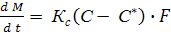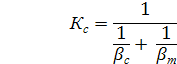Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Равновесие при кристаллизации.Содержание книги
Поиск на нашем сайте
Растворимость вещества в жидких растворителях зависит от химической природы, свойств растворителя, Т и р. Растворители- вода, спирты, углеводороды и др. О увеличении Т также раствор становятся пресыщенными и переходят в состояние неустойчивого равновесия. Переход из неравновесного состояния в равновесное сопровождение выпадения кристаллов. На рис. представлена диаграмма состояния газ- жидк.- тв. тело для расплавов. Точка А является тройкой, в ней в равновесии
Для этой точки А: компоненты- 1,фазы- 3. По првилу фаз Гиббса. Число степеней свободы: С + Ф = К +2 С + 3 = 1 + 2 С = 0 Следовательно при изменении любого параметра (Т или р) произойдет исчезновение одной или двух фаз. Линия ОА- кривая сублимации, они отражает условия перехода твердой фазы в паровую, линия жидкое состоиние. АК- кривая перехода жидкости в газообр. состояние. АВ- условия перехода жид. в твердую фазу. Рт- давление тройной точки Ркр- характ. Критическую точку К. Если Т >Ткр исчезает различие между газом и жидкостью. На фазовое равновесие двухкомпонентных систем могут оказывать влияние три параметра: Т,р и С. Однако при кристаллизации из растворов основном интерес представляют жидк. и тв. фазы данной системы. Поскольку Р незначительно влияет на равновесие между жидкой и тв. фазами, фазовые превращения представлены на диаграмме температуры-концентрация.
(1) и пересыщения (2) от Т. I- Область,соответств. состоянию раствора до насыщения, кристаллизации в этой области не происходит. II- область метастабильная, относительно устойчивая. В III области происходит массовая кристаллизация, кристаллы растут очень быстро. Изогидрическая кристаллизация abc, концентрация уменьшается от Изотермическая кристаллизация – de (T3= const) Концентрация увеличивается, наступает пересыщение, переход из II в III область и массовая кристаллизация. Выбор метода кристаллизация зависят от технико- эконом. расчетов.
Материальный баланс кристаллизации.
По общим потокам.
Баланс по безводному веществу.
М- молекулярная масса кристалла без растворителя
Например, сульфат кристаллизуется при t=50
Если кристаллическая фаза не включает растворитель 𝝀=1
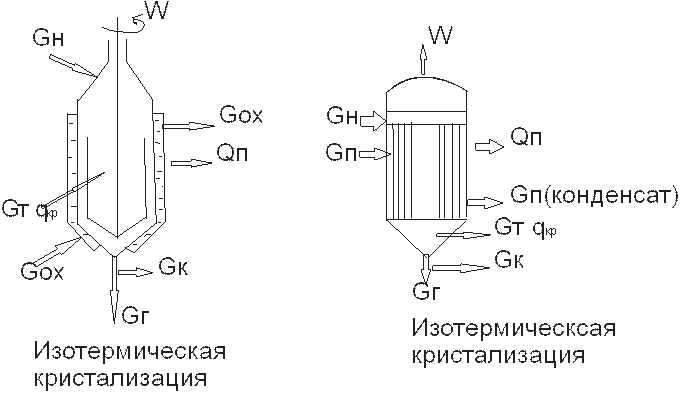
При изотермической кристаллизации (удаление растворителя насыщенного раствора – выпаривание)
При изогидрической кристаллизации (
Тепловой баланс. Изотермическая кристаллизация
C н,т,к – теплоемкость начального раствора,кристаллов,маточного раствора
Q- приход теплоты с теплоносителем
Здесь
Отсюда находят Изолированная кристаллизация
Здесь W=0
Отсюда находить Кинетика процесса кристаллизации.
Кристаллизация идей только в пересыщенных растворах. Разность между концентрации раствора, при которой начинается определение зародышей и концентрация насыщенного раствора называется максимальным пересыщением. Причиной возникновения зародышей кристаллов в растворах является флуктация концентраций. Образуется склонение молекул. Начиная с некоторого радиуса ln
С- концентрация раствора в момент начало кристала
М- молекулярная масса кристаллов
В настоящее время наибольшее распространение получила диффузионная теория роста кристаллов. Сначала перенос молекулкристаллизуемого вещества к поверхности кристаллов и встраивание молекулв кристаллическую решетку. При этом возможно три варианта протекания процесса: 1. Процесс встраивания молекул в кристалл идет с большой скоростью, и кинетика процесса определяется скоростью подвода вещества к поверхности кристалла.
3. Оба процесса протекают с соизмеримым скоростями.
Есть и другие теории: поверхностного натяжения, адсорбционная, дислокационная. На кинетику процесса кристаллы влияет пересыщение, температура, интенсивность перемешивания другие механические воздействия. С ростом температуры растет скорость роста кристаллов. Перемешивание увеличивается скорость образования зародышей кристаллов. Особо чистые вещества можно получить кристаллы. Смеси можно разделить кристаллизацией. Известно 32 вида кристаллов.
|
||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 556; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.109.60 (0.006 с.) |

 одновременно находится газ, жид. и тв.тело.
одновременно находится газ, жид. и тв.тело.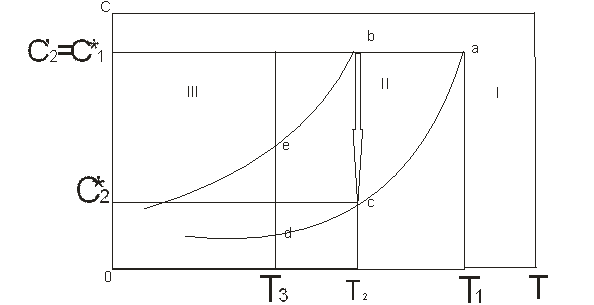 Зависимость равновесной концентрации
Зависимость равновесной концентрации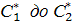 .
.
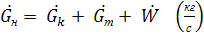 (*)
(*)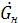 - расход начального раствора
- расход начального раствора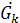 - расход конечного (маточного) раствора
- расход конечного (маточного) раствора - расход кристаллов (кристаллической фазы)
- расход кристаллов (кристаллической фазы) - поток выпаренной воды.
- поток выпаренной воды.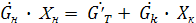 (*+1)
(*+1) - расход кристаллической фазы в пересчете на растворенное вещества
- расход кристаллической фазы в пересчете на растворенное вещества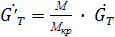
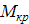 - молекулярная масса кристалла с учетом воды- Кристаллосольвит или ………………………………….
- молекулярная масса кристалла с учетом воды- Кристаллосольвит или …………………………………. как Cu
как Cu  5
5 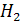 O, при более высоких t как Cu
O, при более высоких t как Cu 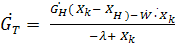
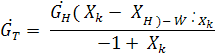
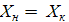 тогда
тогда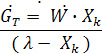
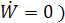
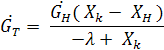


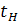 - температура начального раствора
- температура начального раствора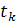 - температура маточного раствора
- температура маточного раствора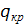 - теплота кристаллизации
- теплота кристаллизации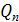 - потери теплоты
- потери теплоты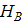 - энтальпия вторачных паров
- энтальпия вторачных паров
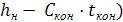 - кон-конденсация.
- кон-конденсация.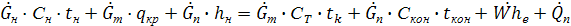
 - греющий пар
- греющий пар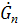 -расход греющего пара.
-расход греющего пара.
 -расход охл. жидкости
-расход охл. жидкости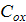 -теплоемкость охл. жидкости
-теплоемкость охл. жидкости -темпер.охл.начального и конечного
-темпер.охл.начального и конечного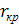 (0,5
(0,5  5нм) начинается рост зародышей.
5нм) начинается рост зародышей.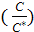 =
= 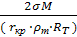
 - поверхностное натяжение
- поверхностное натяжение - равновесная растворимость
- равновесная растворимость - поверхностное натяжение
- поверхностное натяжение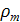 - плотность кристаллов
- плотность кристаллов
 - концентрация вещества у поверхности кристалла
- концентрация вещества у поверхности кристалла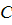 - концентрация вещества в объеме раствора
- концентрация вещества в объеме раствора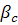 - коэффициент массоотдачи в жидкой фазе
- коэффициент массоотдачи в жидкой фазе - поверхность кристалла
- поверхность кристалла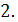 Процесс подвода идет большой скоростью, и кинетика процесса определяется скоростью встраивания молекул в кристалл.
Процесс подвода идет большой скоростью, и кинетика процесса определяется скоростью встраивания молекул в кристалл.
 - концентрация насыщения
- концентрация насыщения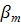 - коэфф. массо отдачи в твердой фазе
- коэфф. массо отдачи в твердой фазе