
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
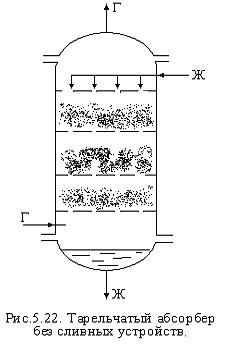
ТА со сливными устройствами.Содержание книги
Поиск на нашем сайте Тарелки бывают колпачковые, ситчатые, клапанные, пластинчатые. Гидродинамические режимы тарелок: 1) пузырьковый увеличение 2) пенный скорости 3)
ТА без сливных устройств. В тарелке без сливных устройств газ и жидкость проходят через одни и те же отверстия и щели. При этом жидкость проваливается на нижнюю тарелку.
Разнообразны конструкции провальных тарелок. Гидродинамические режимы провальных тарелок: при низких wг жидкость на тарелке не задерживается, т.к. мала сила трения на поверхности контакта фаз. При постах точки А происходит скачкообразное увеличение В ТА без сливных устройств большой брызгоунос. Виды тарелок: дырчатые, решёточные, волнистые, трубчатые.
Распыливающие абсорберы. Эти абсорберы подразделяют на следующие группы: 1) полые (форсуночные); 2) скоростные прямоточные; 3) механически распыливающие.
ПЕРЕГОНКА ЖИДКОСТЕЙ. Перегонка жидкостей представляет собой процесс, в котором разделяемая жидкая смесь нагревается до кипения, а образующийся пар отбирается и конденсируется. В результате получают жидкость – конденсат, состав которого отличается от состава начальной смеси. Повторяя много раз процесс испарения конденсата и конденсации, можно практически полностью разделить исходную смесь на чистые составные части (компоненты). Процесс перегонки основан на том, что жидкости составляющие смесь, обладают различным давлением пара при одной и той же температуре. Поэтому состав пара, следовательно, состав конденсата отличается от состава исходной смеси: легколетучего (или низкокипящего - НК) в нем больше, чем в исходной смеси. Очевидно, что в неиспарившейся жидкости концентрация труднолетучего (или высококипящего - ВК) компонента будет больше, чем в исходной смеси. Если исходная смесь состоит из летучего и нелетучего компонента, то их разделяют выпариванием. Посредством же перегонки разделяют смеси, все компоненты которого летучи. Компоненты смеси обладают различной летучестью при одной и той же температуре. Жидкость, полученная в результате конденсации паров наз - ся дистиллятом (ректификатом), оставшаяся часть – остатком. Простая перегонка – процесс однократного частичного испарения смеси и конденсации образовавшихся паров. ПП применяют для разделения смесей, летучести компонентов которой существенно различны. Обычно ПП используют для предварительного грубого разделения жидких смесей. Ректификация - наиболее полное разделение смесей жидкостей, целиком или полностью растворимых друг в друге. Процесс заключается в многократном взаимодействии паров с жидкостью – флегмой, полученной при частичной конденсации паров.
Рис. 5.27 Насадочная ректификационная колона: 1 – колонна, 2 – дефлегматор, 3 - кипятильник Рассмотрим насадочную ректификационную колонну (рис.5.27), в котором снизу движутся пары, а сверху навстречу парам подают жидкость, представляющую почти чистый НК. При взаимодействии поднимающихся паров со стекающей жидкостью происходит частичная конденсация пара и частичное испарение жидкости (флегмы) за счет теплоты конденсации. При этом из пара конденсируется в основном ВК, а из флегмы, в основном, НК. Т.о., стекающая флегма непрерывно обогащается ВК, а поднимающиеся пары – НК. В результате выходящий из колонны пар состоит почти целиком из НК. Пар конденсируют в специальном теплообменнике – конденсаторе (дефлегматор). Часть этого конденсата в виде флегмы идет на орошение колонны, другая часть – дистиллят или ректификат – отбирают как готовый продукт. Для образования восходящих потоков газов колонну снабжают кипятильником, в котором происходит испарение части кубового остатка Кубовый остаток состоит почти из чистого ВК.
3.1. Равновесие в системах жидкость – пар.
В общем случае жидкая смесь может состоять из нескольких компонентов. В простейшем случае из двух, например, из компонентов A и B. Согласно правилу фаз, число степеней свободы такой системы = 2 (два компонента и две фазы). Следовательно, из трех независимых параметров, полностью определяющих состояние системы – T°C, p и концентр. одной из фаз – можно произвольно выбрать любые два: при этом определяется значение третьего параметра, которое не м.б. произвольным. По степени растворимости жидкости делятся: 1. Взаиморастворимые в любых соотношениях 1.1.1. Идеальные растворы – подчиняются закону Рауля 1.1.2. Нормальные растворы – частично подчиняются закону Рауля 1.1.3. Неидеальные растворы – значительно отклоняются от закона Рауля 2. Частично взаиморастворимые 3. Практически взаимонерастворимые.
Рассмотрим взаиморастворимые в любых соотношениях Обозначим состав жидкой фазы через x, паровой фазы – y. Тогда возможны следующие варианты фазовых диаграмм: p – T (x= const), p – x (T= const), T – x (p= const). Для технических расчетов наиболее важна диаграмма T – x,y, т.к. обычно процесс перегонки в пром. аппаратах происходит при P= const, т.е. в изобарных условиях. Закон Рауля Парциальное давление каждого компонента, например, низкокипящего компонента А в паре
По закону Дальтона, общее давление пара над раствором P равно сумме парциальных давлений его компонентов:
Тогда
По закону Дальтона
По уравнению (3.2) по известным
Рис.5.28 Фазовая диаграмма T – x, y.
Линия Линия Любая точка лежащая выше этой кривой, соответствует паровой фазе, пары являются перегретыми. Точка C характеризует систему, температура которой выше температуры кипения и ниже температуры конденсации паров этого же состава. Область между линиями По уравнениям (3.1-3.3) можно получить уравнение линии равновесия:
Уравнение получено для идеальных бинарных систем. Обозначим
Поскольку Взаимное расположение кривых на фазовых диаграммах T – x,y и y – x как для идеальных, так и для реальных систем определяются с помощью законов Коновалова. Законы Коновалова устанавливают связь между изменением состава, давлениями T в 2-х фазных системах, они лежат в основе теории перегонки и ректификации бинарных смесей.
Y
α3 α1 α2
0 x
Рис.5.29 Влияние давления на линию равновесия. Первый закон Коновалова: пар обогащается тем компонентом, при добавлении которого к жидкости повышается давление пара над ней или снижается ее температура кипения, или пар всегда более обогащен НК, чем соответствующая ему жидкая равновесная фаза. Этот закон дополняется первым правилом Вревского, отражающим влияние T на равновесные составы фаз: при повышении T бинарной смеси в парах возрастает относительное содержание того компонента, парциальная молярная теплота испарения которого больше. По рис. 5.28: при Неидеальные растворы (реальные смеси) с полностью взаимной растворимостью компонентов не следует закону Рауля:
Здесь γ – коэффициент активности. Если γ>1 – положительное отклонение, если γ<1 – отрицательное. Определение γ часто затруднено, поэтому диаграмму y – x обычно строят по экспериментальным данным.
Рис.5.30 Фазовые диаграммы.
В реальных системах на фазовых диаграммах P – x(y) и T – x(y) возникают относительные максимумы или минимумы. При этом кривые жидкости и пара соприкасаются друг с другом в экстремальных точках (рис. 5.30). В этих точках составы равновесных фаз одинаковы. Такие смеси называют азеотропными, или азеотропами. Такая смесь при испарении не изменяет своего состава. Поэтому для их разделения применяются спецметоды.
Для таких систем имеется второй закон Коновалова: если давление и T сосуществования 2-х бинарных фаз имеют экстремум (max или min), то составы фаз одинаковы. При изменении внешних условий – температуры или давления значение α изменяет различно по разные стороны от точки азеотропа: одна часть «рыбка» (б, в) должна становиться шире, другая уже. Смещение состава азеотропов при изменении внешних условий определяется вторым законом Вревского: если давление (или T) снижены Ж-П имеет максимум, то при повышении T в азеотропной смеси возрастает концентрация того компонента, парциальная молярная теплота испарения которого больше, а если давление (или T) систем Ж-П имеет минимум, то при повышении T в азеотропной смеси возрастает концентрация компонента с меньшей теплотой испарения. Этот закон определяет возможности разделения азеотропных смесей изменением давления при перегонке. При этом точка азеотропы перемещается на диаграмме y-x и в принципе может совпасть, на диаграмме 8, с правым верхним углом диаграммы. Тогда азеотропную смесь можно разделить перегонкой. Т.о, законы Коновалова характеризуют изменение состояния равновесия 2-х фазных систем при изобарных или изотермических условиях. А законы (правила) Вревского определяют закономерности влияния на фазовое равновесие бинарных систем изменений температуры и давления. Частично растворимые жидкости. Взаимная растворимость существенно зависит от состава и температуры. Обычно растворимость жидкостей с ростом температуры T°С растет.
T
Tкр M
1 2 T1
x x1 x2
Рис. 5.31 Кривая растворимости.
Если задана температура T1, то в области концентраций x<x1 и x>x2 возникает гомогенная система при полной растворимости жидкостей. При этом системы могут подчиняться закону Рауля. В интервале от x1 до x2 образуются 2 нерастворимые друг в друге жидкости с концентрацией x1 в одной жидкой фазе и x2 – в другой. В равновесии с жидкостями находится паровая фаза определенного состава. При T>Tкр образуется гомогенный раствор при смешении жидкостей в любых соотношениях. Концентрация паровой фазы будет зависеть от состава жидкой фазы. Пример - фенол в воде.
Рис.5.32 Диаграммы для смесей жидкостей, ограниченно растворимых друг в друге
|
|||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 433; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.176.215 (0.008 с.) |

 струйный. газа
струйный. газа
 до В. Возникает слой жидкости на тарелке, который вступает во взаимодействие с газом. Возможны разные режимы взаимодействия жидкость-газ до точки С. За пределами точки С наступает захлебывание тарелки.
до В. Возникает слой жидкости на тарелке, который вступает во взаимодействие с газом. Возможны разные режимы взаимодействия жидкость-газ до точки С. За пределами точки С наступает захлебывание тарелки.



 , пропорционально мольной доле
, пропорционально мольной доле  этого компонента в жидкости. При этом коэффициент пропорциональности равен давлению насыщенного пара
этого компонента в жидкости. При этом коэффициент пропорциональности равен давлению насыщенного пара  данного компонента при данной T°C.
данного компонента при данной T°C. (5.100)
(5.100) (5.101)
(5.101) - давление насыщенного пара над чистой жидкостью.
- давление насыщенного пара над чистой жидкостью. (3.1)
(3.1) (3.2)
(3.2) ;
;  (3.3)
(3.3) и
и  при заданной температуре
при заданной температуре  и т.д. находим
и т.д. находим  и т.д. Затем по уравнению (3.4) находим
и т.д. Затем по уравнению (3.4) находим  и т.д. Строим линию кипения жидкости и конденсации паров (рис 5.28).
и т.д. Строим линию кипения жидкости и конденсации паров (рис 5.28).
 - отвечает фазе, находящейся при температуре кипения.
- отвечает фазе, находящейся при температуре кипения. - линия конденсации.
- линия конденсации. и
и  соответствует равновесным парожидкостным системам.
соответствует равновесным парожидкостным системам. (3.4)
(3.4) =α. Поскольку давления насыщенных паров
=α. Поскольку давления насыщенных паров  и
и  компонентов А и В меняются в интервале температур
компонентов А и В меняются в интервале температур  и
и  , то для расчета по (3.4) берут среднее α.
, то для расчета по (3.4) берут среднее α. (3.5)
(3.5) - соответствует ТА,
- соответствует ТА,  - ТВ
- ТВ
 с понижением давления снижается, то α увеличивается. Относительная летучесть α при понижении температуры растет.
с понижением давления снижается, то α увеличивается. Относительная летучесть α при понижении температуры растет.








 = const содержание НК в парах
= const содержание НК в парах  (точка
(точка  ),больше его содержания
),больше его содержания  в равновесной с парами жидкости (точка
в равновесной с парами жидкости (точка  ). При добавлении к смеси НК ее температура кипения снижается, но содержание НК в паре остается выше, чем в жидкости.
). При добавлении к смеси НК ее температура кипения снижается, но содержание НК в паре остается выше, чем в жидкости. и
и  (3.6)
(3.6)





