
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчёт кинетических параметров процессов термического разложенияСодержание книги
Поиск на нашем сайте
Неизотермические методы определения кинетических параметров по сравнению с изотермическими обладают рядом преимуществ: требуется гораздо меньше данных; кинетические параметры могут быть рассчитаны для всего диапазона температур; при нагревании до исследуемой температуры образец часто вступает в реакцию, поэтому результаты, полученные изотермическими методами, нередко оказываются недостоверными; для исследования требуется один образец. Неизотермический метод используется для оценки значения энергии активации термического разложения. Расчёт кинетических параметров по ТГ-кривой основаны на формальном кинетическом уравнении: где m – масса образца, вступившая в реакцию; n – порядок реакции; k – удельная константа скорости реакции разложения. Это уравнение хорошо описывает кинетику термического разложения твёрдых веществ, например оксалатов, перманганатов и перхлоратов металлов. Зависимость удельной константы скорости от температуры описывается уравнением Аррениуса: k = A·e – E / RT , (4.2) где А – предэкспоненциальный множитель; Е – энергия активации, Дж/моль; R – универсальная газовая постоянная, Дж/(моль∙К). Для изучения кинетики разложения используются дифференциальный и интегральный методы, а также метод аппроксимации. Остановимся более подробно на методе расчёта кинетических параметров, получившем наибольшее распространение. Метод Ньюкирка На основании ТГ-кривой Ньюкирк получил выражение для расчета скорости реакции разложения. Для температур Т 1 и Т 2 остаточные массы образца составляют Зависимость ln k = f
Лабораторная работа 8 Определение температурного режима первичной подготовки адсорбента или катализатора и его термостойкости Приборы и реактивы: – Дериватограф Q-1500D; – Образец адсорбента или катализатора в количестве 1 г. Цель работы. Приобретение навыков работы на дериватографе и освоение методики обработки экспериментальных данных. Сущность работы. Подготовка образца адсорбента или катализатора к термическому анализу, получение дериватограмм и их расшифровка.
Порядок проведения работы 1. Образец в количестве 1 г, предварительно высушенный при комнатной температуре, засыпают в тигель. Тигель с образцом помещают на держатель дериватографа. 2. При помощи набора разновесов на приборе устанавливают нулевое положение. 3. На программаторе устанавливают максимальную температуру и необходимую скорость нагрева. 4. Запускают программу. 5. После окончания эксперимента фиксируют максимальное изменение массы образца.
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 174; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.17.239 (0.009 с.) |

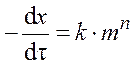 , (4.1)
, (4.1)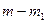 и
и 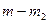 , при этом скорость реакции
, при этом скорость реакции 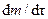 определяется как тангенс углов наклона касательных к ТГ-кривой в точках 1 и 2. Для реакции первого порядка уравнение имеет следующий вид:
определяется как тангенс углов наклона касательных к ТГ-кривой в точках 1 и 2. Для реакции первого порядка уравнение имеет следующий вид: (4.3)
(4.3)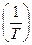 в этом случае носит линейный характер.
в этом случае носит линейный характер.


