Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные положения теории адсорбции индивидуальных веществ
При равновесии системы адсорбент – адсорбтив количество поглощенного вещества (газа или пара) является функцией парциального давления поглощаемого вещества и температуры: a = f (P, T), (1.1) а также свойств адсорбтива и адсорбента. Здесь а – равновесная величина адсорбции (синонимы: адсорбционная ёмкость, адсорбционная активность, концентрация адсорбата в адсорбенте), которая характеризует способность единичной массы (объёма) адсорбента поглощать компоненты очищаемой среды [1,2]. При описании адсорбционного равновесия количество поглощённого вещества обычно выражают в ммолях на 1 г адсорбента, граммах на 1 г адсорбента и в см3 на 1 г адсорбента, а иногда в граммах на 1 см3 адсорбента. В технологических исследованиях чаще используют размерность г/100 г, указывая массу адсорбата, поглощённого 100 г чистого адсорбента. Для технологических расчётов самой удобной размерностью ёмкости является г/м3, т.е. масса поглощенного адсорбата, отнесенная к единице объёма адсорбента. Равновесная величина адсорбции а, зависит от: - природы адсорбента: его пористой структуры, состава, заряда поверхности; - природы адсорбтива: молекулярной массы, заряда, размера молекулы; - условий проведения процесса адсорбции: Т, Р и др. Адсорбция – процесс экзотермический и её протекание всегда сопровождается выделением тепла. В качестве характеристики адсорбционных свойств пористых тел используют зависимость a = f (P) или a = f (c) при Т= const, которая называется изотермой адсорбции. Поддержание постоянной температуры обеспечивается легче, чем поддержание постоянной концентрации в любой из фаз. Поэтому экспериментальный материал по адсорбции обычно получают в виде изотерм адсорбции. Они же часто являются первичным объектом теоретического анализа. В практике использования адсорбционного метода изотерма адсорбции является основной сравнительной характеристикой различных типов адсорбентов и определяет выбор оптимальных рабочих условий процесса. Одновременно совокупность изотерм адсорбции является источником информации о структуре адсорбента, тепловом эффекте адсорбции и ряде других характеристик.
В соответствии с эмпирической классификацией, впервые предложенной Брунауэром, Демингом, Демингом и Теллером (БДДТ), различают несколько основных типов изотерм адсорбции в зависимости от их вида (рис. 1). Форма каждой изотермы относится к определенной текстуре адсорбента.
Рис. 1.1. Типы изотерм адсорбции по классификации Брунауэра, Деминга, Деминга и Теллера
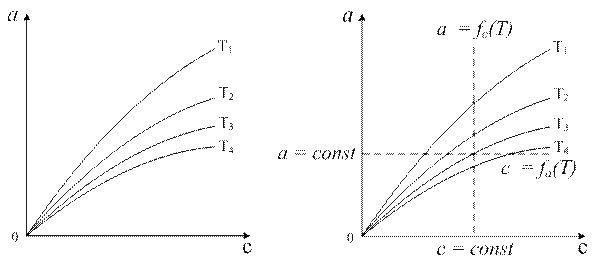
В случае технических адсорбентов тип I характерен для микропористых адсорбентов, практически не имеющих переходных пор. Начальные выпуклые участки изотерм типов II и IV указывают на присутствие существенного объёма микропор наряду с макро- и мезопорами. Менее крутой начальный подъем кривых характерен для мезопористых адсорбентов, где осуществляется моно- и полимолекулярная адсорбция. Вогнутые начальные участки изотерм типов III и V характерны для систем, где взаимодействие молекул адсорбата с адсорбентом (адсорбция на поверхностных активных центрах) намного меньше межмолекулярного взаимодействия молекул адсорбата (например, вызванного проявлением водородных связей). Основным отличием изотерм типов II от IV и III от V заключается в том, что объём мезопор (IV и V типы) в результате капиллярной конденсации заполняется адсорбатом раньше, чем относительное давление адсорбата приблизится к единице. В результате этого на изотермах появляется верхний, почти горизонтальный участок. Для практического использования в адсорбционной технике представляют интерес преимущественно типы I, II и IV, поскольку при подобных видах изотерм достигаются высокие сорбционные ёмкости адсорбентов при низких концентрациях адсорбтива. Следует, однако, подчеркнуть, что тип изотерм определяется не только адсорбентом, во многом он зависит от соответствующей системы адсорбент – адсорбат. Например, изотермы адсорбции на одном и том же активном угле относятся к типу I по адсорбции СCl4 и к типу V по адсорбции паров воды. Величина адсорбции возрастает по мере увеличения концентрации (или парциального давления) адсорбата и убывает с ростом температуры (рис. 1.2 а).
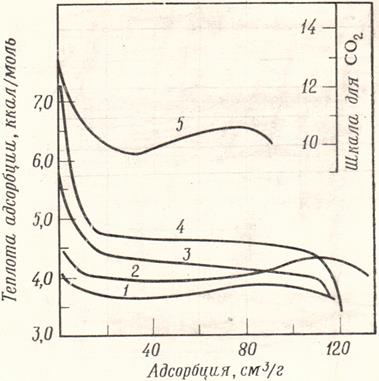
Рис. 1.2. а) Изотермы адсорбции: T1<T2<T3< T 4; б) Построение изостер Для отдельных случаев представляет интерес также изобара адсорбции, т.е. температурная зависимость адсорбции при постоянном парциальном давлении: a = f (Т) при Р= const. Зависимость a = f (Т) при с= const называется изопикной. Эти зависимости можно снять экспериментально, а можно получить из изотерм (рис. 1.2 б). При наличии изотерм адсорбции изопикны (изобары) адсорбции получают путём сечения семейства изотерм вертикальными линиями, отвечающими условию с = const (Р = const). Изостерой адсорбции называется температурная зависимость концентрации (парциального давления) адсорбтива при постоянной величине адсорбции, с=fa(T); она также представляет интерес в практике применения адсорбентов. Изостеры адсорбции получают путём сечения изотерм горизонтальными линиями, отвечающими условию: а=const (рис. 1.2 б). По изостерам адсорбции можно рассчитать изостерическую теплоту адсорбции. Согласно уравнению Клапейрона–Клаузиуса: где ΔН – теплота (энтальпия) адсорбции, кДж/моль; R – универсальная газовая постоянная, кДж/(моль.К). В координатах ln P = f ( 1 / T) по тангенсу угла наклона линейных изостер адсорбции вычисляют дифференциальную теплоту адсорбции, которую часто называют изостерической. Дифференциальная теплота адсорбции характеризует тепловой эффект в интервале изменения степени заполнения адсорбционного пространства, стремящемся к нулю. Она отнесена к единице сорбирующегося вещества и измеряется в кДж/моль. Построение изостер при разных заполнениях поверхности адсорбента позволяет проследить изменение дифференциальной теплоты адсорбции от заполнения. По мере заполнения поверхности абсолютное значение изостерической теплоты адсорбции уменьшается. Интегрируя зависимость дифференциальной теплоты адсорбции от заполнения по степени заполнения, мы получим интегральную теплоту адсорбции, измеряемую в кДж. Одновременное использование изотерм и изостер адсорбции позволяет определить два важнейших свойства системы: величину и теплоту адсорбции. Теплота адсорбции является основной энергетической характеристикой, определяющей природу и величину сил, вызывающих адсорбцию. Исследуя зависимость теплоты адсорбции от количества адсорбированного вещества можно сделать определённые выводы о характере поверхности адсорбента и величине взаимодействия адсорбат–адсорбат. Зависимости дифференциальной теплоты адсорбции от степени заполнения различны. Часто они носят убывающий характер. При наличии сильного взаимодействия адсорбированных молекул друг с другом в начальной или средней областях заполнения адсорбционной ёмкости наблюдается пик локального увеличения теплоты адсорбции. Нижним пределом дифференциальной теплоты адсорбции является теплота конденсации. Это характерно для степеней заполнения, близких к предельным. На рис. 1.3 в качестве примера приведены зависимости дифференциальных теплот адсорбции газов на природном шабазите от величины адсорбции [3].
Рис. 1.3. Дифференциальная теплота адсорбции газов на природном шабазите: 1 - Ar, 2 – O2, 3 – N2, 4 – CO, 5 – CO2 Основной термодинамической функцией адсорбции в микропорах является дифференциальная максимальная мольная работа адсорбции А, равная изменению свободной энергии Гиббса. А= − Δ G = RT ln (Ps /Р), (1.3) где Р – равновесное давление пара при температуре Т, Ps – давление насыщенного пара при температуре Т. Введение летучестей взамен давлений позволяет учитывать отклонение от идеальности газовой фазы.
|
||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 182; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.211.66 (0.012 с.) |


 а) б)
а) б)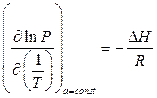 , (1.2)
, (1.2)