Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электронные конфигурации некоторых элементовСодержание книги
Похожие статьи вашей тематики
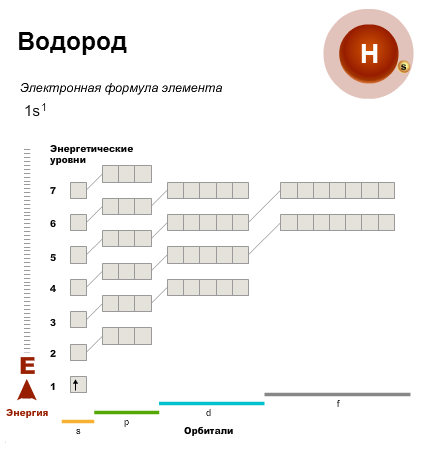
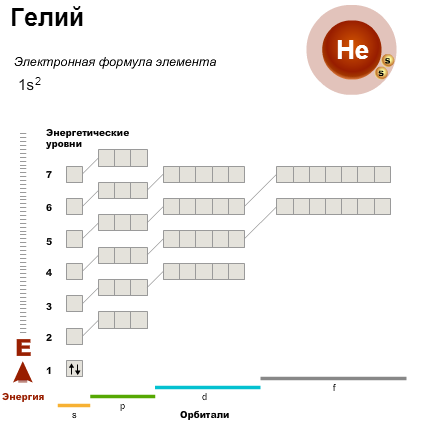
Поиск на нашем сайте Первый энергетический уровень вмещает максимально два электрона. Поэтому первый период состоит лишь из двух элементов — водорода и гелия. Простейший из атомов — водород, H. Он содержит один электрон, который занимает орбиталь с самой низкой энергией — 1s-орбиталь. Электронная конфигурация атома водорода. В атоме гелия первый энергетический уровень полностью завершен.
У элементов второго периода начинается заполнение второго энергетического уровня — он включает восемь электронов (n = 2, N = 8). Второй период содержит восемь элементов. У неона, элемента, завершающего второй период, первый и второй энергетические уровни оказываются целиком заполненными.
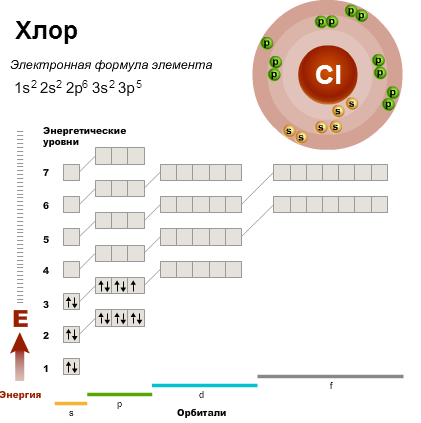
В третьем периоде происходит заполнение третьего энергетического уровня. Третий уровень (n = 3) может максимально вмещать 18 электронов. Однако элементов в третьем периоде всего восемь. К концу третьего периода (у аргона) полностью заполняются 3s- и 3p-подуровни, а 3d-подуровень остается пустым, поэтому третий уровень не заполняется до конца.
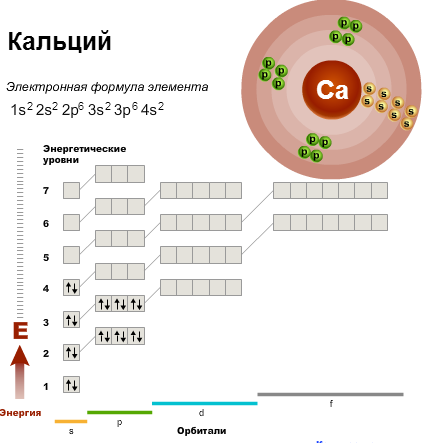
В четвертом периоде у первых двух элементов (калия и кальция) электроны идут на четвертый энергетический уровень (4s-подуровень), а затем у последующих десяти элементов (от скандия до цинка) завершается заполнение третьего энергетического уровня (3d-подуровня).
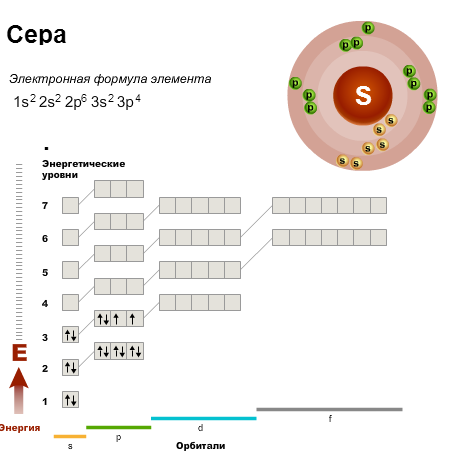
Определение Элементы, в атомах которых происходит заполнение предвнешнего энергетического уровня, называют переходными. Такие элементы расположены в побочных подгруппах периодической системы. Начиная с элемента галлия заполнение четвертого уровня продолжается. Химические свойства элементов определяются не всеми электронами, а только внешними, обладающими наибольшей энергией. Внешние электроны называют валентными, и их количество, как правило, равно номеру группы, в которой расположен элемент. Их атом может отдавать в результате химических реакций, они обуславливают его химические свойства. У элементов главных подгрупп валентными являются электроны внешнего энергетического уровня. Число валентных электронов равно номеру группы, в которой находится элемент. Например, водород, натрий и калий, расположенные в первой группе, имеют по одному валентному электрону, а элементы четвертой группы — углерод и кремний — по четыре. Как вы помните, элементы, входящие в одну и ту же подгруппу, обладают сходными химическим свойствами. Это объясняется тем, что они имеют сходные электронные конфигурации, т. е. являются электронными аналогами. Полностью завершенные внутренние энергетические уровни не оказывают существенного влияния на химические свойства. Элементы, в атомах которых валентные электроны расположены на s-подуровне, называют s-элементами, p-подуровне — p-элементами, d-подуровне — d-элементами, а f-подуровне — f-элементами. s-элементы расположены в начале периодов, а р-элементы — в конце. В короткопериодном варианте периодической системы f-элементы (лантаноиды и актиноиды) вынесены за пределы таблицы. Малые периоды и главные подгруппы состоят лишь из s- и р-элементов. Все d- и f-элементы расположены в побочных подгруппах. В длиннопериодном варианте s-, p-, d- и f-элементы занимают отдельные поля. Именно конфигурация валентных электронов определяет то, является ли элемент металлом или неметаллом, с какими другими элементами он может взаимодействовать и какова его валентность. При заполнении орбиталей электронами конфигурация валентных электронов периодически повторяется, что приводит к периодическому изменению химических свойств элементов. Пример Записать электронную конфигурацию и энергетическую диаграмму атома серы, указав распределение электронов по уровням и подуровням. Решение Сера расположена в третьем периоде и VI (6) группе, порядковый номер — 16.
Значит, в атоме серы всего 16 электронов, которые расположены на трех энергетических уровнях (т. к. номер периода = 3), причем на последнем (валентном) уровне находится 6 электронов (т. к. номер группы = 6). В соответствии с принципом минимума энергии расположим электроны по подуровням. Электронная конфигурация атома серы тогда выглядит следующими образом: 1S22S22P63S23P4.
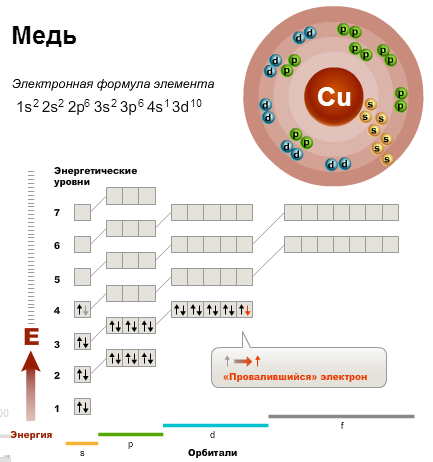
«Проскок» или «провал» электрона У атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место «провал» электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома. Например, электронная формула атома меди, исходя из вышенаписанного, должна иметь вид: Cu 1s22s22p63s23p64s23d9_. Однако в действительности один из двух 4s-электронов «проваливается» на 3d-подуровень, и атом меди имеет следующую конфигурацию: 1s22s22p63s23p64s13d10_.
Для элементов IБ-подгруппы характерна конфигурация внешнего слоя: ns1(n−1)d10. Для элементов Cr и Mo характерна конфигурация внешнего слоя: ns1(n−1)d5. Особо следует отметить палладий, у которого «проваливаются» два электрона: Pd1s22s22p63s23p64s23d104p65s04d10_.
|
||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 624; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.007 с.) |