Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Агрегатное состояние вещества, переходы
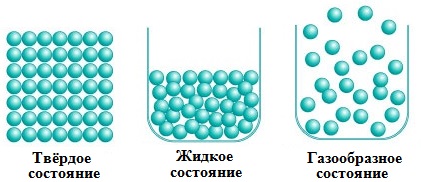
Вещества могут находиться в различных агрегатных состояниях: твердом, жидком, газообразном. Молекулярные силы в разных агрегатных состояниях различны: в твердом состоянии они наибольшие, в газообразном — наименьшие. Различием молекулярных сил объясняются свойства, которые проявляются в разных агрегатных состояниях:
В твердых телах расстояние между молекулами маленькое и преобладают силы взаимодействия. Поэтому твердые тела обладают свойством сохранять форму и объем. Молекулы твердых тел находятся в постоянном движении, но каждая молекула движется около положения равновесия. В жидкостях расстояние между молекулами побольше, значит, меньше и силы взаимодействия. Поэтому жидкость сохраняет объем, но легко меняет форму. В газах силы взаимодействия совсем невелики, так как расстояние между молекулами газа в несколько десятков раз больше размеров молекул. Поэтому газ занимает весь предоставленный ему объем. Переходы из одного агрегатного состояния вещества в другое
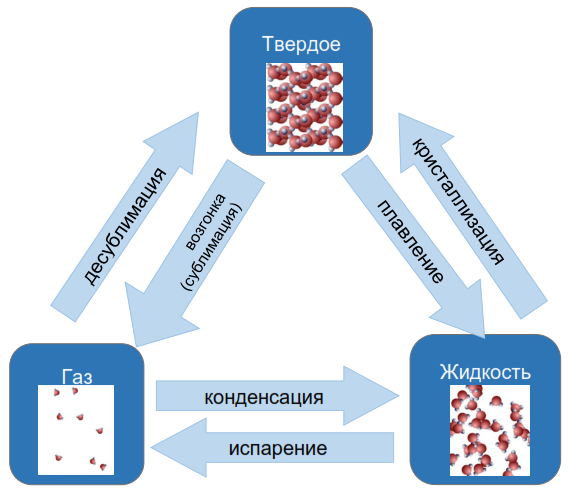
Определение Плавление вещества − переход вещества из твердого состояния в жидкое. Этот фазовый переход всегда сопровождается поглощением энергии, т. е. к веществу необходимо подводить теплоту. При этом внутренняя энергия вещества увеличивается. Плавление происходит только при определенной температуре, называемой температурой плавления. Каждое вещество имеет свою температуру плавления. Например, у льда плСtпл=00С. Пока происходит плавление, температура вещества не изменяется. Что надо сделать, что расплавить вещество массой m? Сначала нужно его нагреть до температуры плавления плtпл, сообщив количество теплоты c⋅m⋅ΔT, где c − удельная теплоемкость вещества. Затем необходимо подвести количество теплоты λ⋅m, где λ − удельная теплота плавления вещества. Само плавление будет происходить при постоянной температуре, равной температуре плавления.
Определение Кристаллизация (затвердевание) вещества − переход вещества из жидкого состояния в твердое. Это процесс, обратный плавлению. Кристаллизация всегда сопровождается выделением энергии, т. е. от вещества необходимо отводить теплоту. При этом внутренняя энергия вещества уменьшается. Она происходит только при определенной температуре, совпадающей с температурой плавления. Пока происходит кристаллизация, температура вещества не изменяется. Что надо сделать, что вещество массой m кристаллизовалось? Сначала нужно его охладить до температуры плавления плtпл, отведя количество теплоты c⋅m⋅ΔT, где c − удельная теплоемкость вещества. Затем необходимо отвести количество теплоты λ⋅m, где λ − удельная теплота плавления вещества. Кристаллизация будет происходить при постоянной температуре, равной температуре плавления. Определение Парообразование вещества − переход вещества из жидкого состояния в газообразное. Этот фазовый переход всегда сопровождается поглощением энергии, т. е. к веществу необходимо подводить теплоту. При этом внутренняя энергия вещества увеличивается. Различают два вида парообразования: испарение и кипение. Определение Испарение − парообразование с поверхности жидкости, происходящее при любой температуре. Скорость испарения зависит от:
Определение Кипение − парообразование по всему объему жидкости, которое происходит только при определенной температуре, называемой температурой кипения. Каждое вещество имеет свою температуру кипения. Например, у воды кипСtкип=1000С. Пока происходит кипение, температура вещества не изменяется. Что надо сделать, чтобы вещество массой m выкипело? Сначала нужно его нагреть до температуры кипения кипtкип, сообщив количество теплоты c⋅m⋅ΔT, где c − удельная теплоемкость вещества. Затем необходимо подвести количество теплоты L⋅m, где L − удельная теплота парообразования вещества. Само кипение будет происходить при постоянной температуре, равной температуре кипения.
Определение Конденсация вещества − переход вещества из газообразного состояния в жидкое. Это процесс, обратный парообразованию. Конденсация всегда сопровождается выделением энергии, т. е. от вещества необходимо отводить теплоту. При этом внутренняя энергия вещества уменьшается. Она происходит только при определенной температуре, совпадающей с температурой кипения. Пока происходит конденсация, температура вещества не изменяется. Что надо сделать, чтобы вещество массой m сконденсировалось? Сначала нужно его охладить до температуры кипения кипtкип, отведя количество теплоты c⋅m⋅ΔT, где c − удельная теплоемкость вещества. Затем необходимо отвести количество теплоты L⋅m, где L − удельная теплота парообразования вещества. Конденсация будет происходить при постоянной температуре, равной температуре кипения. Химическая связь Причины образования химической связи Известно, что электронные оболочки, содержащие восемь внешних электронов, два из которых находятся на s- орбитали, а шесть — на р -орбиталях, обладают повышенной устойчивостью. Они соответствуют инертным газам: неону, аргону, криптону, ксенону, радону (найдите их в периодической таблице). Еще более устойчив атом гелия, содержащий всего два электрона. Атомы всех других элементов стремятся приблизить свою электронную конфигурацию к электронной конфигурации ближайшего инертного газа. Это возможно сделать двумя путями — отдавая или присоединяя электроны внешнего уровня.
Каждый элемент в большей или меньшей степени обладает способностью притягивать электроны, которая численно характеризуется значением электроотрицательности. Соответственно, чем больше электроотрицательность элемента, тем сильнее он притягивает электроны и тем сильнее выражены его окислительные свойства. Стремление атомов приобрести устойчивую электронную оболочку объясняет причину образования молекул. Определение Химическая связь — это взаимодействие атомов, обусловливающее устойчивость химической молекулы или кристалла как целого. ТИПЫ химической связи Различают 4 основных типа химической связи:
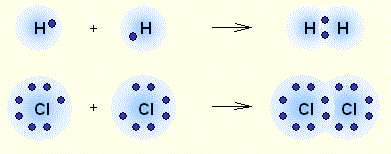
Рассмотрим взаимодействие двух атомов с одинаковыми значениями электроотрицательности, например двух атомов хлора. Каждый из них имеет по семь валентных электронов. До электронной конфигурации ближайшего инертного газа им не хватает по одному электрону.
Сближение двух атомов до определенного расстояния приводит к образованию общей электронной пары, одновременно принадлежащей обоим атомам. Эта общая пара и представляет собой химическую связь. Аналогично происходит и в случае молекулы водорода. У водорода всего один неспаренный электрон, и до конфигурации ближайшего инертного газа (гелия) ему не хватает еще одного электрона. Таким образом, два атома водорода при сближении образуют одну общую электронную пару.
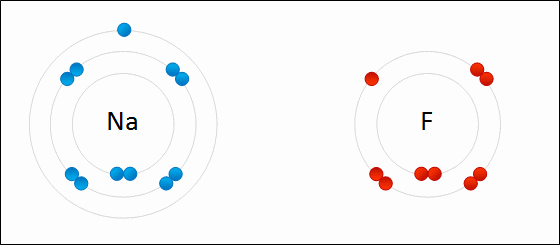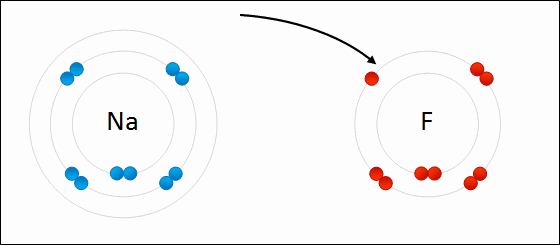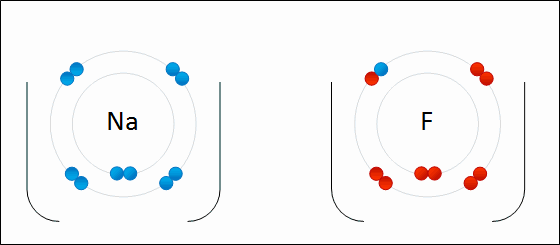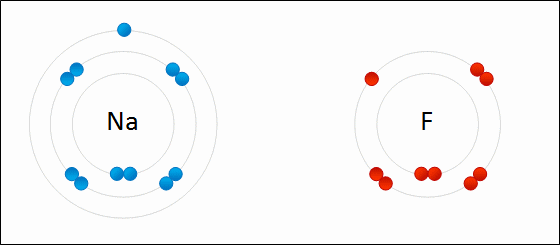
Определение Связь между атомами неметаллов, возникающая при взаимодействии электронов с образованием общих электронных пар, называется ковалентной. В случае если взаимодействующие атомы имеют равные значения электроотрицательности, общая электронная пара в равной степени принадлежит обоим атомам, то есть находится на равном расстоянии от обоих атомов. Такая ковалентная связь называется неполярной. Определение Ковалентная неполярная связь — химическая связь между атомами неметаллов с равными или близкими значениями электроотрицательности. При этом общая электронная пара одинаково принадлежит обоим атомам, смещения электронной плотности не наблюдается. Ковалентная неполярная связь имеет место в простых веществах-неметаллах: О2,N2,Cl2,P4,O3. При взаимодействии атомов, имеющих различные значения электроотрицательности, например водорода и хлора, общая электронная пара оказывается смещенной в сторону атома с большей электроотрицательностью, то есть в сторону хлора. Атом хлора приобретает частичный отрицательный заряд, а атом водорода — частичный положительный. Это пример ковалентной полярной связи. Определение Связь, образованная элементами-неметаллами с разной электроотрицательностью, называется ковалентной полярной. При этом происходит смещение электронной плотности в сторону более электроотрицательного элемента. Молекула, в которой разделены центры положительного и отрицательного зарядов, называется диполем. Полярная связь имеет место между атомами с различной, но не сильно различающейся электроотрицательностью, например между различными неметаллами. Примерами соединений с полярными ковалентными связями являются соединения неметаллов друг с другом, а также различные ионы, содержащие атомы неметаллов (NO3–,CH3COO–). Особенно много ковалентных полярных соединений среди органических веществ. В случае если разница электроотрицательностей элементов будет велика, произойдет не просто смещение электронной плотности, а полная передача электрона от одного атома к другому. Рассмотрим это на примере фторида натрия NaF. Как мы видели ранее, атом натрия стремится отдать один электрон, а атом фтора готов его принять. Это легко осуществляется при их взаимодействии, которое сопровождается переходом электрона.
При этом атом натрия полностью передает свой электрон атому фтору: натрий лишается электрона и становится заряженным положительно, а хлор приобретает электрон и становится заряженным отрицательно. Определение Атомы и группы атомов, несущие на себе заряд, называют ионами. В образовавшейся молекуле — фториде натрия Na+F− — связь осуществляется за счет электростатического притяжения разноименно заряженных ионов. Такую связь называют ионной. Она реализуется между типичными металлами и неметаллами, то есть между атомами с сильно различающимися значениями электроотрицательности. Определение Ионная связь образована за счет сил электростатистического притяжения между разноименно заряженными ионами — катионами и анионами. Существует еще один тип связи — металлическая, характерная для простых веществ — металлов. Она характеризуется притяжением частично ионизованных атомов металлов и валентных электронов, образующих единое электронное облако («электронный газ»). Валентные электроны в металлах являются делокализованными и принадлежат одновременно всем атомам металла, свободно перемещаясь по всему кристаллу. Таким образом, связь является многоцентровой. В переходных металлах металлическая связь носит частично ковалентный характер, так как дополнена перекрыванием частично заполненных электронами d-орбиталей предвнешнего слоя. Металлы образуют металлические кристаллические решетки. О ней подробно рассказывается в теме «Металлическая связь и ее характеристики».
|
||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 418; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.172.146 (0.014 с.) |