Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные типы расчетных задач. Алгоритмы решения
Основные формулы
Для решения расчетных задач лучше всего использовать формулу, связывающую большинство величин через количество вещества: n=m/M=V/Vm=N/NA Решение задач на нахождение количества, массы и объема вещества, количества частиц. Задача 1 Какова масса 3 моль кислорода? Решение n(O2)=3 m(O2) n=mM⇒m=n⋅M O2 M(O2)=Mr(O2)=2⋅Ar(O)=2⋅16=32 m(O2)=n(O2)⋅M(O2)=3моль⋅32г/моль=96г Ответ: масса 3 моль кислорода - 96г Задача 2 Какой объем занимает 34г аммиака? Сколько молекул содержится в этом объеме? Решение Дано: m(NH3)=34г Найти: V(NH3) =? N(NH3) =? Решение: Такие задачи удобнее всего решать через нахождение количества вещества, в моль. 1) Найдем количество аммиака, которое содержится в указанной массе: гг/мольмольn(NH3)=m(NH3)M(NH3)=34г17г/моль=2моль 2) Зная количество вещества, легко найти его объем: л/мольмольлV(NH3)=Vm⋅n(NH3)=22,4л/моль⋅2моль=44,8л частиц/мольмольмолекулN(NH3)=Na⋅n(NH3)=6,02⋅1023частиц/моль⋅2моль=12⋅1023молекул Ответ: 34 г аммиака занимает объем, равный 44,8л и содержит 12⋅1023 молекул Массовая доля как понятие
Например, кусок арбуза, изображенный на рисунке, составляет одну четверть от целого арбуза, то есть его доля равна 1/4 или 25%. Чтобы лучше понять, что такое массовая доля представьте себе килограмм конфет (1000г), который мама купила своим трем детям. Из этого килограмма самому младшему ребенку досталась половина всех конфет (несправедливо конечно!). Старшему — лишь 200г, а среднему — 300г. Значит массовая доля конфет у младшего ребенка составит половину, или 1/2 или 50%. У среднего ребенка будет 30%, а у старшего — 20%. Следует подчеркнуть, что массовая доля может быть безразмерной величиной (четверть, половина, треть, 1/5, 1/6 и т.д.), а может измеряться в процентах (%). При решении расчетных задач массовую долю лучше переводить в безразмерную величину.
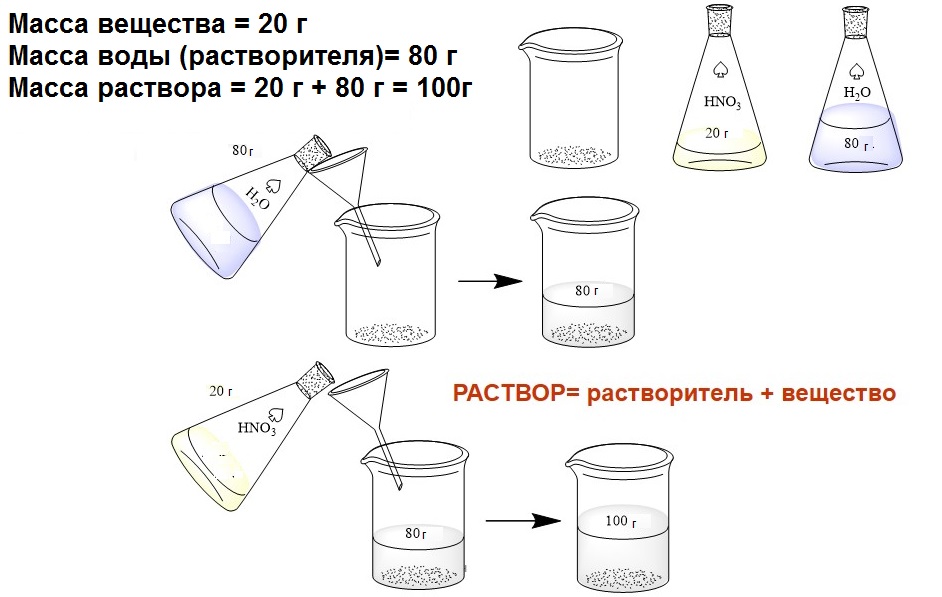
Массовая доля вещества в растворе
Любой раствор состоит из растворителя и растворенного вещества. Вода — самый распространенный неорганический растворитель. Органическими растворителями могут быть спирт, ацетон, диэтиловый эфир и др. Если в условии задачи не указана растворитель, раствор считается водным. Массовая доля растворенного вещества рассчитывается по формуле: ωв-ва=mв-ва /mр-ра(⋅100%) Рассмотрим примеры решения задач. Задача Сколько граммов сахара и воды нужно взять для приготовления 150г 10%-ного раствора сахара? Решение ДАНО: m(р-ра)=150г ω(сахара)=10%=0,1 НАЙТИ: m(сахара)=? m(воды)=? РЕШЕНИЕ: m(сахара) = (сахара)ггω(сахара)⋅m(p−pa)=0,1⋅150г=15г m(воды)=m(р-ра) - m(сахара) = 150г - 15г=135г. ОТВЕТ: нужно взять 15г сахара и 135г воды. Задача Раствор объемом 350 мл. и плотностью 1, 142 г/мл содержит 28 г хлорида натрия. Найти массовую долю соли в растворе. Решение ДАНО: V(р-ра)=350 мл. ρ(р-ра)=1,142 г/мл m(NaCl)=28 г НАЙТИ: ω(NaCl)=? РЕШЕНИЕ: m(р-ра) =V(р-ра) ⋅ρ(р-ра)=350 мл ⋅ 1,142 г/мл=400г (р-ра)ггω(NaCl)=m(NaCl)m(р-ра)=28г/400г=0,07=7% ОТВЕТ: массовая доля хлорида натрия ω(NaCl)=7% МАССОВАЯ ДОЛЯ ЭЛЕМЕНТА В МОЛЕКУЛЕ Формула химического вещества, например H2SO4, несет в себе много важной информации. Она обозначает либо отдельную молекулу вещества, которая характеризуется относительной атомной массой, либо 1 моль вещества, который характеризуется молярной массой. Формула показывает качественный (состоит из водорода, серы и кислорода) и количественный состав (состоит из двух атомов водорода, атома серы и четырех атомов кислорода). По химической формуле можно найти массу молекулы в целом (молекулярную массу), а также вычислить соотношение масс элементов в молекуле: m(H): m(S): m(O) = 2: 32: 64 = 1: 16: 32. При вычислении соотношений масс элементов нужно учитывать их атомную массу и количество соответствующих атомов: m(H2)=1∗2=2, m(S)=32∗1=32, m(O4)=16∗4=64
Принцип расчета массовой доли элемента аналогичен принципу расчета массовой доли вещества в растворе и находится по схожей формуле: эл-таэл-та(атомовмолекулыωэл-та=Arэл-та⋅n(атомов)mмолекулы(⋅100%) Задача Найти массовую долю элементов в серной кислоте. Решение Способ 1 (пропорция): Найдем молярную массу серной кислоты: M(H2SO4)=1⋅2+32+16⋅4=98г/моль
Одна молекула серной кислоты содержит один атом серы, значит масса серы в серной кислоте составит: г/моль m(S)=Ar(S)⋅n(S)=32г/моль⋅1= 32г/моль Примем массу всей молекулы за 100%, а массу серы — за Х% и составим пропорцию: M(H2SO4)=98 г/моль — 100% m(S) = 32г/моль — Х% Откуда г/мольг/мольX=32г/моль⋅100%98г/моль=32,65%=32% Способ 2 (формула): эл-та(атомовмолекулыг/мольг/моль ω(S)=Arэл-та⋅*n(атомов)/mмолекулы*(⋅100%) =Ar(S)⋅1/M(H2SO4) *(⋅100%)=32г/моль⋅1/98г/моль(⋅100%)≈32,7% Аналогично по формуле рассчитаем массовые доли водорода и кислорода: г/мольг/мольω(H)=Ar(H)⋅2M(H2SO4)(⋅100%)=1г/моль⋅298г/моль(⋅100%)≈2% г/мольг/мольω(O)=Ar(O)⋅4M(H2SO4)(⋅100%)=16г/моль⋅498г/моль(⋅100%)≈65,3%
Термохимические уравнения Определение Термохимические уравнения — уравнения химических реакций с указанием теплового эффекта реакции. Например: гггжкДжCH4(г)+2O2(г)=CO2(г)+2H2O(ж)+890кДж
гггкДж2H2(г)+O2(г)=2H2O(г)+572кДж
гггкДжN2(г)+O2(г)⇔2NO(г)−180кДж
тггкДжS(т)+O2(г)=SO2(г)+297кДж Следует помнить, что тепловой эффект — стандартная величина для определенной реакции. Точные значения можно найти в справочнике физико-химических величин. При этом тепловой эффект реакции пропорционален количеству реагентов и продуктов. Например, в реакции ггкДж3O2(г)⇔2O3(г)−284кДж 3 моль кислорода превращаются в 2 моль озона с поглощением 284 кДж, значит, для превращения 6 моль кислорода в озон потребуется в два раза больше теплоты, то есть (284⋅2)= 568 кДж. Эту пропорциональную зависимость легко увидеть, если писать количества каждого вещества под уравнением реакции и помнить, что в химической реакции коэффициент перед веществом отражает его количество (в моль): ггкДж3O2(г)⇔2O3(г)−284кДж мольмолькДж3моль2моль−284кДж по уравнению реакции мольмолькДж1.5моль1моль−142кДж в два раза меньше мольмолькДж6моль4моль−586кДж в два раза больше мольмолькДж15моль10моль−1420кДж в пять раз больше мольмолькДж30моль20моль−2840кДж в 10 раз больше Задача 1 Сколько теплоты выделится при сгорании 67,2 л метана по уравнению реакции: гггжкДжCH4(г)+2O2(г)=CO2(г)+2H2O(ж)+890кДж Решение Из уравнения реакции видно, что в соответствии со стехиометрией при сгорании 1 моль метана (коэффициент в уравнении равен 1) образуется 890 кДж. Решить задачу можно двумя способами, очень похожими друг на друга. В обоих вариантах решения в основе лежит принцип пропорциональности, заложенный в уравнении химической реакции и отраженный в коэффициентах реакции. Способ 1 1. Найдем количество метана, исходя из условий задачи: лл/мольмольn(CH4)=V(CH4)Vm=67,2л22,4л/моль=3моль 2. Составим пропорцию: по уравнению реакции: 1 моль метана приводит к выделению 890 кДж тепла по условию задачи: 3 моль — Х кДж тепла 1моль3моль=890кДжXкДж⟹X=3моль⋅890кДж1моль=2670кДж
Способ 2 Можно составить пропорцию не по количеству вещества, а по объему участвующего газа. В уравнении реакции участвует 1 моль метана, значит, его объем мольл/мольлV(CH4)=n(CH4)⋅Vm=1моль⋅22,4л/моль=22,4л по уравнению реакции: 22,4 л/моль метана приводит к выделению 890 кДж тепла по условию задачи: 67,2 л — Х кДж тепла
22,4л67,2л=890кДжXкДж⟹X=67,2л⋅890кДж22,4л=2670кДж Ответ: 2670 кДж (способ решения не влияет на ответ). Задача 2 Сколько теплоты выделится при сгорании 36 кг угля? тггкДжC(т)+O2(г)=CO2(г)+394кДж Решение Эту задачу также можно решить составлением одной из двух пропорций. Способ 1 1. Найдем количество угля, исходя из условий задачи: гг/мольмольn(C)=m(C)M(C)=36000г12г/моль=3000моль 2. Составим пропорцию: по уравнению реакции: 1 моль угля сгорает с выделением 394 кДж тепла по условию задачи: 3000 моль — Х кДж тепла мольмолькДжкДжмолькДжмолькДж1моль3000моль=394кДжXкДж⟹X=3000моль⋅394кДж1моль=1182000кДж Способ 2 1. мольг/мольгm(C)=n(C)⋅M(C)=1моль⋅12г/моль=12г 2. По уравнению реакции: 12 г угля сгорает с выделением 394 кДж тепла по условию задачи: 36 кг = 36 000 г — Х кДж тепла ггкДжкДжгкДжгкДж12г36000г=394кДжXкДж⟹X=36000г⋅394кДж12г=1182000кДж Ответ: 1 182 000 кДж. Задача 3 Какой объем азота нужно сжечь, чтобы поглотилось 900 кДж тепла? гггкДжN2(г)+O2(г)⇔2NO(г)−180кДж Решение 1. Составим пропорцию (по молям): по уравнению реакции: 1 моль азота сгорает с поглощением 180 кДж тепла по условию задачи: Х моль — 900 кДж тепла мольмолькДжкДжмолькДжкДжмоль1мольXмоль=180кДж900кДж⟹X=1моль⋅900кДж180кДж=5моль 2. По найденному количеству азота найдем его объем: мольл/мольлV(N2)=n(N2)⋅Vm(N2)=5моль⋅22,4л/моль=112л Ответ: 112 л. Задача 4 Сколько моль озона образуется по уравнению, если поглотилось 852 кДж тепла? 3O2(г)⇔2O3(г)−284кДж
Составим пропорцию (по молям): по уравнению реакции: 1 моль азона сгорает с поглощением 284 кДж тепла по условию задачи: Х моль — 852 кДж тепла мольмолькДжкДжмолькДжкДжмоль1мольXмоль=284кДж852кДж⟹X=1моль⋅852кДж284кДж=3моль Ответ: 3 моль. Вывод формулы вещества
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 209; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.119.148 (0.026 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
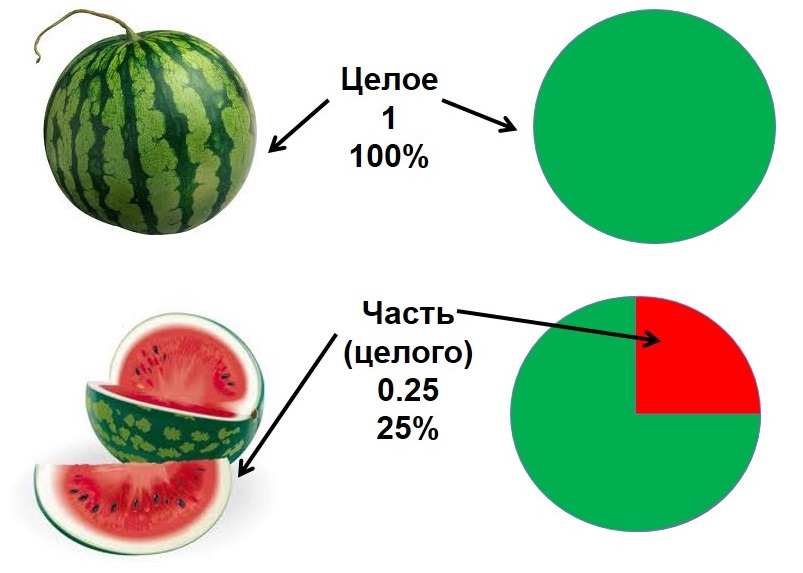 Понятие "доли" наверняка вам уж знакомо.
Понятие "доли" наверняка вам уж знакомо.