Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Н ахождение молекулярной формулы по продуктам сгорания (класс вещества известен)
Еще одним вариантом заданий №40 являются задачи, когда известен класс исходного вещества Х или его общая формула, масса (объем) исходного вещества или реагента Y и масса продукта реакции Z. Конечная цель: определить исходное вещество Х. Алгоритм решения таких задач аналогичен случаю 2. Рассмотрим пример решения такой задачи. Задача 3. При сгорании 112 л (н. у.) неизвестного углеводорода в избытке кислорода образуется 336 л углекислого газа. Установите структурную формулу циклоалкана. Решение 1. Общая формула гомологического ряда циклоалканов: CnH2n. При полном сгорании циклоалканов, как и при горении любых углеводородов, образуются углекислый газ и вода. В общем виде уравнение реакции записывается: CnH2n+1,5nO2→nCO2+nH2O . Обратите внимание: коэффициенты в уравнении реакции в данном случае зависят от n! 2. Известно, что в ходе реакции образовалось 336 л/22,4 л = 15 моль углекислого газа, а в реакцию вступило 112/22,4 = 5 моль углеводорода. Следовательно, на 5 моль циклоалкана образуется 15 моль CO2, а на 5 молекул углеводорода соответственно образуется 15 молекул углекислого газа, т. е., одна молекула циклоалкана дает 3 молекулы CO2. Поскольку каждая молекула оксида углерода (IV) содержит по одному атому углерода, можно сделать вывод: в одной молекуле циклоалкана содержится 3 атома углерода. Вывод: n = 3, формула циклоалкана - C3H6. 3. Данной молекулярной формуле соотвествует только одно вещество, относящееся к классу циклоалканов - циклопропан. Н АХОЖДЕНИЕ МОЛЕКУЛЯРНОЙ ФОРМУЛЫ ПО ПРОДУКТАМ реакций (КЛАСС ВЕЩЕСТВА НЕИЗВЕСТЕН) Более сложным вариантом такого типа задач являются задачи, когда неизвестен класс исходного вещества, но известны массы (объемы) продуктов реакции или реагентов. В этом случае обычно даются дополнительные сведения об исходном веществе, позволяющие определить молекулярную массу или класс соединения: плотность паров по какому-нибудь газу (воздуху, водороду и т.д.), характерные химические особенности (например, способность присоединять галоген и т.д.). Рассмотрим пример решения такой задачи. Задача 4. Неизвестное органическое вещество, не содержащее азот, массой 0,4 г сожгли и продукты сгорания пропустили через трубку с безводным сульфатом меди (II) и раствор баритовой воды. При этом сульфат окрасился в голубой цвет, а масса трубки увеличилась на 0,36 г., а при взаимодействии с баритовой водой выпал белый осадок, массой 5,91 г. Установите формулу вещества.
Решение 1. Исходное вещество может содержать атомы углерода, водорода и кислорода. Составим уравнения возможных реакций: Горение: CxHyOz+O2⟶CO2+H2O Поглощение безводным сульфатом меди: CuSO4+5H2O⟶CuSO4⋅5H2O Образование осадка: CO2+Ba(OH)2⟶BaCO3↓+H2O 2. Находим количественный состав исходного вещества. Масса образовавшейся воды составляет 0,36 г, поскольку вся вода была поглощена безводным сульфатом меди, тогда количество вещества воды: n(H2O)=0,36/18=0,02 моль. Следовательно количество вещества водорода n(H)=0,02⋅2=0,04 моль.Тогда масса водорода в исходном веществе составляет: m(H)=0,04⋅1=0,04 г. Масса образовавшегося карбоната бария составляет 5,91 г., следовательно n(BaCO3)=5,91/197=0,03 моль. Тогда n(CO2)=n(BaCO3)=0,03 моль. Определяем количество вещества и массу углерода в исходном веществе: n(C)=0,03 моль, m(C)=0,03⋅12=0,36 г. Получается, что исходное вещество не содержит кислорода, так как 0,36+0,04=0,4 г. 3. Находим простейшую формулу вещества: X:Y = 0,03:0,04 = 3:4. Молекулярная формула вещества: C3H4. 4. Данной молекулярной формуле соответствуют три вещества, относящиеся к разным классам: CH≡C−CH3 - пропин (метилацетилен); CH2=C=CH2 - пропадиен (аллен) и циклопропен Электролиз Теория электролитической диссоциации (ТЭД) Электролитическая диссоциация Понятие электролитов впервые ввел М. Фарадей в первой половине XIX века. Согласно его определению: Определение Электролитами называют вещества, водные растворы или расплавы которых проводят электрический ток. Опустим в стакан с водой графитовые стержни, присоединенные к источнику тока и связанные цепью с электрической лампой. При включении рубильника никаких видимых изменений не происходит. Это означает, что вода не проводит электрический ток, то есть не является электролитом. Внесем в стакан с водой поваренную соль – хлорид натрия, NaCl. Лампа ярко вспыхивает.Наличие проводимости свидетельствует о появлении в растворе заряженных частиц. Направленное движение частиц наблюдается также в расплавах солей (например, электролиз расплава хлорида натрия позволяет получать металлический натрий, выделяющийся на катоде и газообразный хлор на аноде).
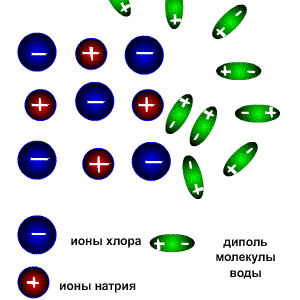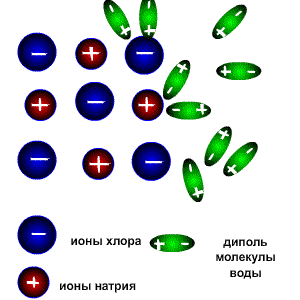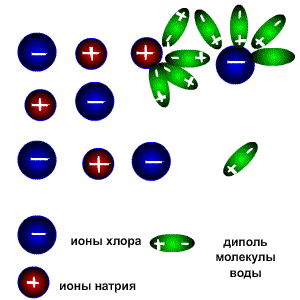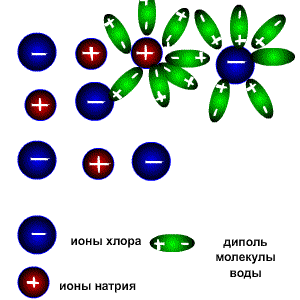
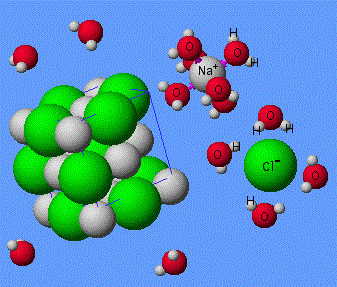
Определение Атомы и группы атомов, несущие электрический заряд, называют ионами. Положительно заряженные ионы называют катионами, отрицательно заряженные ионы - анионами. Проведя дополнительный опыт, можно убедиться, что сухая поваренная соль не проводит электрический ток. Таким образом, можно сделать вывод, что свободные ионы появляются в расплаве и при растворении соли в воде. Рассмотрим на атомарном уровне, что происходит с кристаллом поваренной соли при попадании его в воду. Соль – вещество с ионной кристаллической решеткой, в узлах которой расположены катионы натрия и анионы хлора. Они удерживаются друг около друга благодаря силам электростатического притяжения. Молекула воды представляет собой диполь, так как на атомах водорода локализованы частичные положительные заряды, на на атоме кислорода – отрицательный.
В молекуле воды атомные орбитали кислорода находятся в sp3-гибридизации (то есть имеет форму тетраэдра), причем две недостающие орбитали из четырех образованы двумя парами электронов (электронная конфигурация внешнего уровня кислорода 2s22p4). Поэтому между связями в молекуле воды угол составляет примерно 104 градуса, то есть молекула имеет не линейную, а угловую форму. Благодаря этому молекула воды является диполем, и ее дипольный момент не равен нулю. Для объяснения свойств водных растворов электролитов С. Аррениус в 1887 году предложил теорию электролитической диссоциации. Эта теория объясняла, почему растворы некоторых веществ проводят электрический ток, но не отвечала на вопрос, почему одни вещества являются электролитами, а другие - нет. Более подробно особенности поведения веществ в растворах описал Д.И. Менделеев, который экспериментально доказал, что при растворении электролитов происходит химическое взаимодействие между молекулами растворенного вещества и молекулами растворителя. Сущность процесса электролитической диссоциации было объяснено на основании природы химической ионной связи. Согласно теории Д.И. Менделеева, электролитическая диссоциация молекул электролитов протекает в три стадии. Рассмотрим эти стадии на примере поваренной соли NaCl. 1. При попадании в воду, молекулы воды окружают кристаллы поваренной соли, притягиваясь к катионам натрия своими отрицательно заряженными концами, а к анионам хлора - положительно заряженными. Эта стадия называется ассоциация. 2. За счет электростатического взаимодействия, молекулы воды "растаскивают" молекулу электролита, связь между ионами в кристалле ослабевает и разрывается, то есть происходит непосредственно диссоциация (распад) молекул. 3. Диполи воды полностью окружают образовавшиеся при распаде ионы, катионы и анионы, образуя гидратную оболочку. Гидратированные ионы переходят в раствор.
В неводных растворах в качестве диполей может выступать не вода, а другой полярный растворитель, например, этанол. В таком случае ионы окружены молекулами растворителя (образуют сольватную оболочку) и называются сольватированными.
Определение Ионы в водном растворе окружены молекулами воды, то есть имеют гидратную оболочку, и называются гидратированными.
Таким образом, описанный выше процесс можно описать уравнением: NaCl(aq)→Na(aq)++Cl(aq)− где Na(aq)+,Cl(aq)− - гидратированные ионы,т.е. ионы, окруженные молекулами воды. В большинстве случаев этот процесс записывают упрощенно, не указывая гидратированное состояние ионов: NaCl(aq)→Na++Cl− Определение Процесс распада вещества на ионы при растворении в воде или расплавлении называют электролитической диссоциацией. Электролитическая диссоциация состоит из двух одновременно протекающих обратных процессов: из диссоциации (распад молекул на ионы) и ассоциации (процесс образования молекул из ионов). Поэтому в уравнении электролитической диссоциации всегда ставят знак ↔. В водных растворах диссоциации подвержены кислоты, сильные основания и растворимые соли: HCl↔H++Cl–
NaOH↔Na++OH−
Al2(SO4)3↔2Al3++3SO42– При диссоциации происходит резкое увеличение числа частиц в растворе – это отличает растворы электролитов от растворов неэлектролитов. Именно поэтому растворы солей замерзают при более низкой температуре, чем растворы неэлектролитов. Особенно сильно гидратирован ион водорода H+. Он находится в водных растворах в виде иона гидроксония H3O+ или более сложных ионов.
|
|||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 397; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.46.36 (0.012 с.) |