Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные положения Теории электролитической диссоциации
Согласно теории электролитической диссоциации С. Аррениуса и Д. И. Менделеева можно сформулировать основные положения теории электролитической диссоциации (ТЭД):
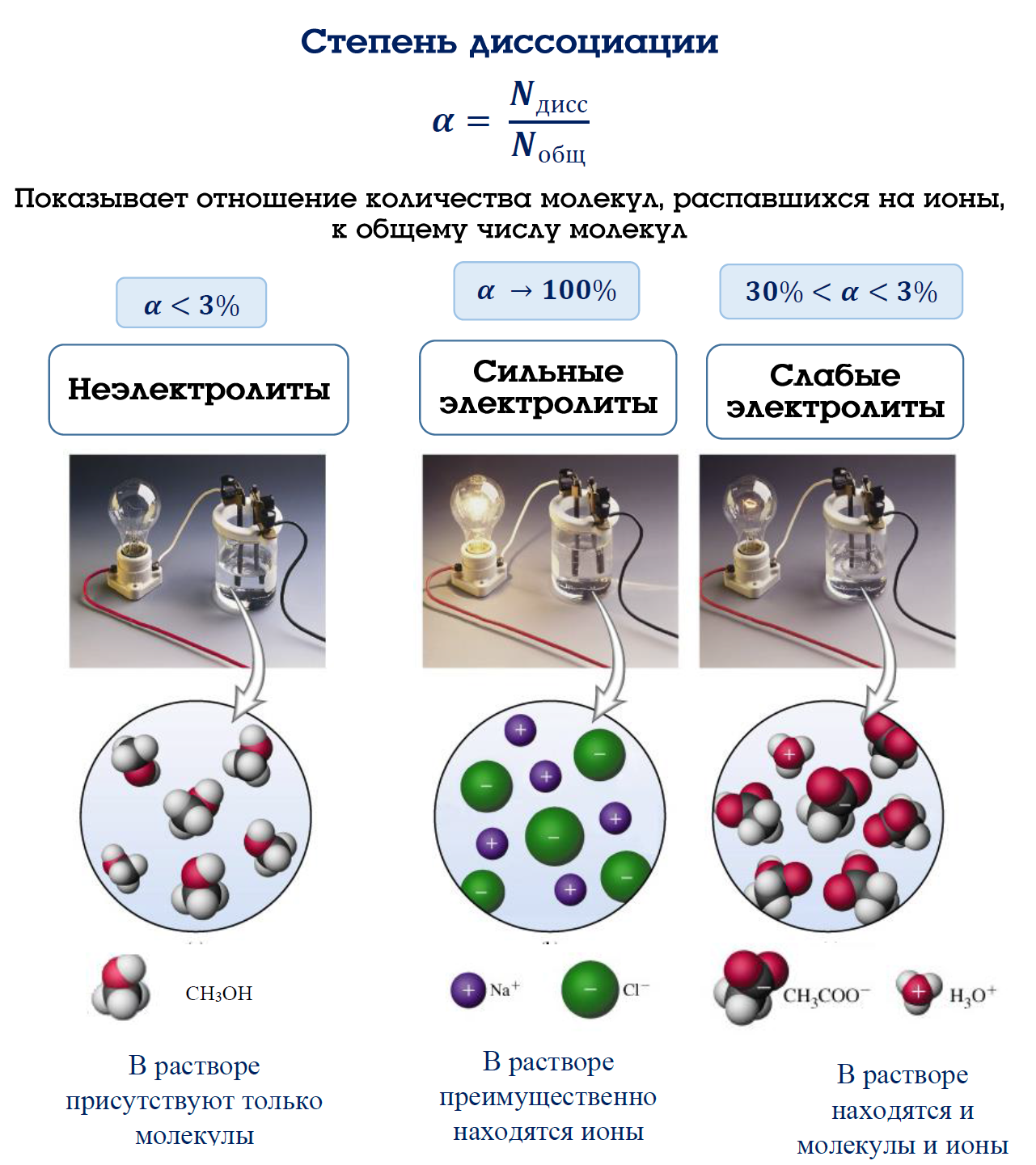
Определение Степень электролитической диссоциации α показывает отношение числа молекул, распавшихся на ионы общ(Nобщ) к общему числу молекул, введенных в раствордисс.(Nдисс.) и зависит от природы электролита и растворителя, температуры и концентрации: дисс.общα=Nдисс.Nобщ Основываясь на теории электролитической диссоциации можно дать определения важнейшим классам неорганических соединений
Определение Электролитами называют вещества, водные растворы или расплавы которых проводят электрический ток. К электролитам относят большинство неорганических соединений и растворимые соли органических кислот. Большинство органических соединений не проводят электрический ток и относятся к неэлектролитам. Согласно теории электролитической диссоциации, предложенной С. Аррениусом, для количественной оценки диссоциации используют количественный показатель - степень диссоциации. Определение Степень диссоциации (α) – это отношение числа частиц, распавшихся на ионы общ(Nобщ) к общему числу частиц, введенных в раствордисс.(Nдисс.):
дисс.общα=Nдисс/Nобщ Степень диссоциации зависит от следующих факторов:
КЛАССИФИКАЦИЯ ЭЛЕКТРОЛИТОВ По степени диссоциации электролиты делятся на сильные (α>30%) и слабые (α<30%).
Все растворимые соли (в том числе соли органических кислот) являются сильными электролитам. Кроме того, электролитами являются растворы кислот и щелочей (растворимых оснований), при этом сила кислот и оснований зависит от степени диссоциации: Электролиты | |||||||||||||||||||||
| Сильные α >30% | Слабые α < 30% | |||||||||||||||||||||
| кислоты |
|
| ||||||||||||||||||||
| основания |
|
| ||||||||||||||||||||
Определение
Сильные электролиты - это такие электролиты, которые в водных растворах (даже концентрированных) практически полностью диссоциируют на ионы. Степень диссоциации.стремится к единице (100%)
Сильные электролиты диссоциируют практически необратимо, поэтому в их водных растворах не содержится исходных молекул или негидратированных ионов, в уравнении диссоциации используют символ "→"
Определение
Слабые электролиты - не полностью диссоциируют на ионы в водных растворах. Их степень диссоциации значительно меньше единицы, а в большинстве случаев стремится к нулю
Диссоциация слабых электролитов обратима, то есть одновременно с ней протекает и противоположный процесс – ассоциация, в уравнении используют символ "⇔"
|
|
В растворах слабых электролитов преобладают не ионы, а недиссоциированные молекулы. Именно этим, например, объясняется, что растворы уксусной кислоты сохраняют запах даже при сильном разбавлении водой (обонятельные рецепторы реагируют на молекулы веществ, а не на ионы).
С точки зрения теории электролитической диссоциации можно рассматривать строение и свойства кислот, оснований и солей.
Определение
Кислоты - это электролиты, которые в растворе диссоциируют с образованием катионов только одного типа - гидратированных ионов водорода.
Диссоциация сильных кислот протекает в одну стадию, то есть одноступенчато, с одновременным отщеплением всех катионов водорода:
H2SO4→2H++SO42−
HNO3→H++NO3−
Слабые кислоты диссоциируют многоступенчато (число ступеней диссоциации = числу атомов Н в кислоте):
I) H2CO3⇔H++HCO3− гидрокарбонат-ион
II) HCO3−⇔H++CO32− карбонат-ион
Определение
Основания - это электролиты, которые в растворе диссоциируют с образованием в качестве отрицательных ионов только гидроксид-анионов.
Диссоциация сильных оснований протекает в одну стадию, то есть одноступенчато при этом происходит отщепление сразу всех гидроксо-групп:
NaOH→Na++OH−
Ca(OH)2→Ca2++2OH−
Слабые основания диссоциируют многоступенчато (число ступеней = числу гидроксильных групп):
I) Cr(OH)3⇔OH−+Cr(OH)2+ катион дигидроксохрома (III)
II) Cr(OH)2+⇔OH−+Cr(OH)2+ катион гидроксохрома (III)
III) Cr(OH)2+⇔OH−+Cr3+ катион хрома (III)
Определение
Соли - это электролиты, которые диссоциируют в растворе с образованием катиона металла и аниона кислотного остатка:
NaOH→Na++OH–
K2SO4→2K++SO42–.
Кислые соли диссоциируют с образованием катиона металла и сложного аниона, состоящего из водорода и кислотного остатка. Сложный анион затем диссоциирует на катион водорода и анион кислотного остатка:
I) KH2PO4⇔K++H2PO4−+ дигидрофосфат-ион
II) H2PO4−⇔H++HPO42− гидрофосфат-ион
III) HPO42−⇔H++PO43− фосфат-ион
Основные соли диссоциируют с образованием аниона кислотного остатка и сложного катиона, состоящего из гидроксогруппы и металла. Сложный катион затем диссоциирует на гидроксид-ион и катион металла:
I) (Fe(OH)2)2SO4⇔SO42−+2Fe(OH)2+ катион дигидроксожелеза (III)
II) Fe(OH)2+⇔OH−+Fe(OH)2+ катион гидроксожелеза (III)
III) Fe(OH)2+⇔OH−+Fe3+ катион железа (III)
Обратимые реакции
Как уже говорилось ранее, вещества, вступающие в химическую реакцию, называются реагентами, а получающиеся в ходе химического превращения — продуктами реакции. По правилам, реагенты записываются в левой части уравнения, а продукты — в правой. Однако в реакционной смеси может протекать как взаимодействие реагентов, так и взаимодействие продуктов, и такие реакции называются обратимыми.
Определение
Реакции, которые при заданных условиях протекают как в прямом, так и в обратном направлении, называют обратимыми.
Чтобы отразить возможность протекания такой реакции в прямом и обратном направлении, в химическом уравнении не ставят знак «равно», а используют символ «»«⇔»:
реагентыпродуктыреагенты⇔продукты.
Следует отметить, что обратимы практически все химические реакции. Но для протекания некоторых типов реакций в противоположном направлении требуются большие затраты энергии; тогда их считают необратимыми.
|
|
Обратимые реакции очень распространены в химии. К ним относятся диссоциация воды и слабых кислот, гидролиз некоторых солей, реакции водорода с бромом, иодом и азотом, многие промышленно важные реакции, такие как
(г)(г)(г)2SO2(г)+O2(г)=2SO3(г)
(г)(г)(г)CO(г)+2H2(г)=CH3OH(г)
(г)(г)(г)2CH4(г)=C2H2(г)+3H2(г)
(г)(г)(г)C2H4(г)+H2O(г)=C2H5OH((г)
(т)(г)(г)(г)C(т)+H2O(г)=CO(г)+H2(г)
(г)(г)(г)(г)CH4(г)+H2O(г)=CO(г)+3H2(г).
С точки зрения эффективности проведения промышленного химического процесса, обратимость реакций является негативным фактором, так как выход продукта в таких реакциях не превышает 30 %.
Химическое равновесие
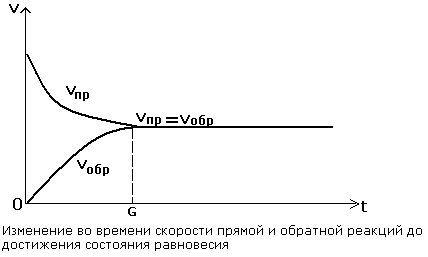
Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока обе скорости не станут равными и не установится состояние химического равновесия.
Направление протекания химической реакции определяется условиями ее проведения (температурой, давлением, концентрацией веществ).
При равновесии все количества веществ постоянны, поэтому возникает впечатление, что в системе ничего не происходит. На самом деле и прямая, и обратная реакции протекают одновременно и с одинаковой скоростью: сколько продуктов образуется за счет прямой реакции, столько же их расходуется в обратной реакции. Химическое равновесие имеет динамический характер.
Определение
Химическое равновесие — состояние химической реакции, при котором количества исходных веществ и продуктов не меняются со временем.
Состав равновесной смеси, состоящей из реагентов и продуктов, зависит от условий. Если в смеси продуктов больше, чем исходных веществ, то говорят, что равновесие смещено вправо, в сторону продуктов реакции. Если же в смеси преобладают исходные вещества, а продуктов мало, то считают, что равновесие смещено влево, то есть в сторону исходных веществ.