
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химия. Лекция №2. Алгоритмы решения задачСтр 1 из 25Следующая ⇒
Химия. Лекция №2. Алгоритмы решения задач Превращения веществ - химические реакции Все вещества подвергаются изменениям. Например:
Эти изменения имеют разную природу: в первом случае изменяется только агрегатное состояние, следовательно, происходит физический процесс, а в двух других образуются новые вещества. Определение Превращения, сопровождающиеся образованием новых соединений, отличающихся по строению и составу от исходных, называются химическими превращениями. В ходе химических реакций обязательно происходит разрушение старых химических связей и образование новых. Важно понимать, что новые вещества могут иметь тот же количественный состав, что и исходные, например в реакции изомеризации бутана:
В этой реакции количественный состав соединения не поменялся: и до, и после реакции написана формула вещества общей формулой C4H10. Однако свойства этих веществ отличаются друг от друга вследствие их разного строения. Определение В ходе физического превращения может происходить изменение формы, агрегатного состояния или других физических параметров вещества, но при этом не происходит изменение состава и строения вещества. Примерами физических превращений могут быть испарение воды (вода в жидком и газообразном состоянии имеет одинаковое строение и состав: H2O), измельчение соли (уменьшится лишь размер частиц, состав и строение останется прежним), таяние льда. Определение Химическая реакция — это превращение одних веществ (реагентов) в другие, отличающиеся по химическому составу или строению (продукты реакции). ПРИЗНАКИ ХИМИЧЕСКИХ РЕАКЦИЙ Химическое превращение от физического всегда можно отличить по наличию одного или нескольких признаков:
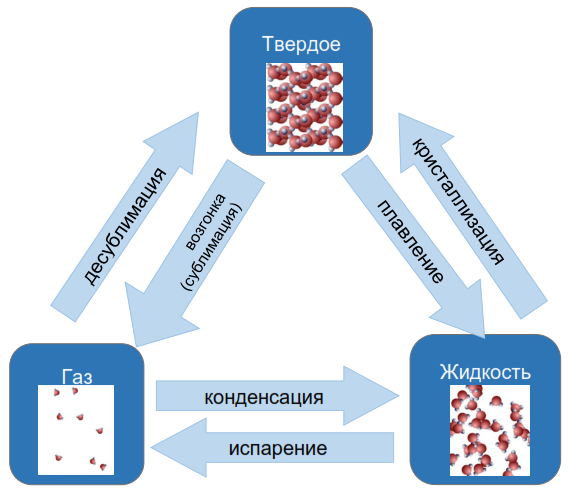
Переходы из одного агрегатного состояния вещества в другое
Определение Плавление вещества − переход вещества из твердого состояния в жидкое.
Этот фазовый переход всегда сопровождается поглощением энергии, т. е. к веществу необходимо подводить теплоту. При этом внутренняя энергия вещества увеличивается. Плавление происходит только при определенной температуре, называемой температурой плавления. Каждое вещество имеет свою температуру плавления. Например, у льда плСtпл=00С. Пока происходит плавление, температура вещества не изменяется. Что надо сделать, что расплавить вещество массой m? Сначала нужно его нагреть до температуры плавления плtпл, сообщив количество теплоты c⋅m⋅ΔT, где c − удельная теплоемкость вещества. Затем необходимо подвести количество теплоты λ⋅m, где λ − удельная теплота плавления вещества. Само плавление будет происходить при постоянной температуре, равной температуре плавления. Определение Кристаллизация (затвердевание) вещества − переход вещества из жидкого состояния в твердое. Это процесс, обратный плавлению. Кристаллизация всегда сопровождается выделением энергии, т. е. от вещества необходимо отводить теплоту. При этом внутренняя энергия вещества уменьшается. Она происходит только при определенной температуре, совпадающей с температурой плавления. Пока происходит кристаллизация, температура вещества не изменяется. Что надо сделать, что вещество массой m кристаллизовалось? Сначала нужно его охладить до температуры плавления плtпл, отведя количество теплоты c⋅m⋅ΔT, где c − удельная теплоемкость вещества. Затем необходимо отвести количество теплоты λ⋅m, где λ − удельная теплота плавления вещества. Кристаллизация будет происходить при постоянной температуре, равной температуре плавления. Определение Парообразование вещества − переход вещества из жидкого состояния в газообразное. Этот фазовый переход всегда сопровождается поглощением энергии, т. е. к веществу необходимо подводить теплоту. При этом внутренняя энергия вещества увеличивается. Различают два вида парообразования: испарение и кипение. Определение Испарение − парообразование с поверхности жидкости, происходящее при любой температуре.
Скорость испарения зависит от:
Определение Кипение − парообразование по всему объему жидкости, которое происходит только при определенной температуре, называемой температурой кипения. Каждое вещество имеет свою температуру кипения. Например, у воды кипСtкип=1000С. Пока происходит кипение, температура вещества не изменяется. Что надо сделать, чтобы вещество массой m выкипело? Сначала нужно его нагреть до температуры кипения кипtкип, сообщив количество теплоты c⋅m⋅ΔT, где c − удельная теплоемкость вещества. Затем необходимо подвести количество теплоты L⋅m, где L − удельная теплота парообразования вещества. Само кипение будет происходить при постоянной температуре, равной температуре кипения. Определение Конденсация вещества − переход вещества из газообразного состояния в жидкое. Это процесс, обратный парообразованию. Конденсация всегда сопровождается выделением энергии, т. е. от вещества необходимо отводить теплоту. При этом внутренняя энергия вещества уменьшается. Она происходит только при определенной температуре, совпадающей с температурой кипения. Пока происходит конденсация, температура вещества не изменяется. Что надо сделать, чтобы вещество массой m сконденсировалось? Сначала нужно его охладить до температуры кипения кипtкип, отведя количество теплоты c⋅m⋅ΔT, где c − удельная теплоемкость вещества. Затем необходимо отвести количество теплоты L⋅m, где L − удельная теплота парообразования вещества. Конденсация будет происходить при постоянной температуре, равной температуре кипения. Химическая связь Причины образования химической связи Известно, что электронные оболочки, содержащие восемь внешних электронов, два из которых находятся на s- орбитали, а шесть — на р -орбиталях, обладают повышенной устойчивостью. Они соответствуют инертным газам: неону, аргону, криптону, ксенону, радону (найдите их в периодической таблице). Еще более устойчив атом гелия, содержащий всего два электрона. Атомы всех других элементов стремятся приблизить свою электронную конфигурацию к электронной конфигурации ближайшего инертного газа. Это возможно сделать двумя путями — отдавая или присоединяя электроны внешнего уровня.
Каждый элемент в большей или меньшей степени обладает способностью притягивать электроны, которая численно характеризуется значением электроотрицательности. Соответственно, чем больше электроотрицательность элемента, тем сильнее он притягивает электроны и тем сильнее выражены его окислительные свойства. Стремление атомов приобрести устойчивую электронную оболочку объясняет причину образования молекул. Определение Химическая связь — это взаимодействие атомов, обусловливающее устойчивость химической молекулы или кристалла как целого.
ТИПЫ химической связи Различают 4 основных типа химической связи:
Рассмотрим взаимодействие двух атомов с одинаковыми значениями электроотрицательности, например двух атомов хлора. Каждый из них имеет по семь валентных электронов. До электронной конфигурации ближайшего инертного газа им не хватает по одному электрону.
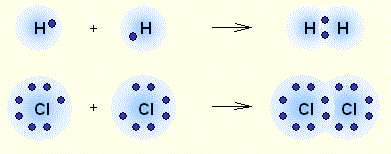
Сближение двух атомов до определенного расстояния приводит к образованию общей электронной пары, одновременно принадлежащей обоим атомам. Эта общая пара и представляет собой химическую связь. Аналогично происходит и в случае молекулы водорода. У водорода всего один неспаренный электрон, и до конфигурации ближайшего инертного газа (гелия) ему не хватает еще одного электрона. Таким образом, два атома водорода при сближении образуют одну общую электронную пару.
Определение Связь между атомами неметаллов, возникающая при взаимодействии электронов с образованием общих электронных пар, называется ковалентной. В случае если взаимодействующие атомы имеют равные значения электроотрицательности, общая электронная пара в равной степени принадлежит обоим атомам, то есть находится на равном расстоянии от обоих атомов. Такая ковалентная связь называется неполярной. Определение Ковалентная неполярная связь — химическая связь между атомами неметаллов с равными или близкими значениями электроотрицательности. При этом общая электронная пара одинаково принадлежит обоим атомам, смещения электронной плотности не наблюдается. Ковалентная неполярная связь имеет место в простых веществах-неметаллах: О2,N2,Cl2,P4,O3. При взаимодействии атомов, имеющих различные значения электроотрицательности, например водорода и хлора, общая электронная пара оказывается смещенной в сторону атома с большей электроотрицательностью, то есть в сторону хлора. Атом хлора приобретает частичный отрицательный заряд, а атом водорода — частичный положительный. Это пример ковалентной полярной связи. Определение Связь, образованная элементами-неметаллами с разной электроотрицательностью, называется ковалентной полярной. При этом происходит смещение электронной плотности в сторону более электроотрицательного элемента. Молекула, в которой разделены центры положительного и отрицательного зарядов, называется диполем. Полярная связь имеет место между атомами с различной, но не сильно различающейся электроотрицательностью, например между различными неметаллами. Примерами соединений с полярными ковалентными связями являются соединения неметаллов друг с другом, а также различные ионы, содержащие атомы неметаллов (NO3–,CH3COO–). Особенно много ковалентных полярных соединений среди органических веществ.
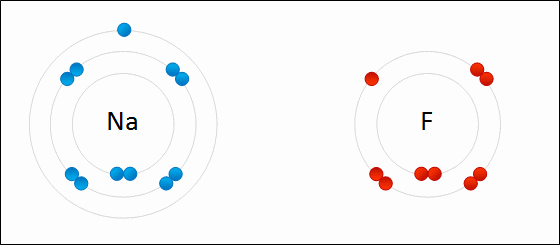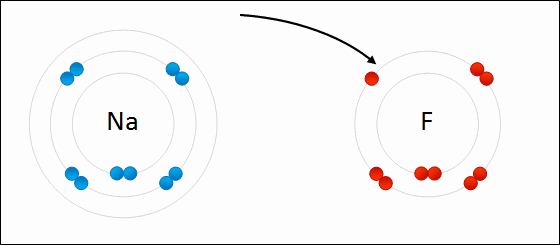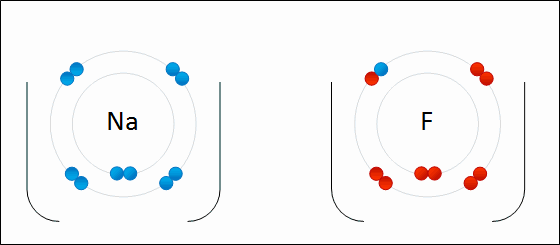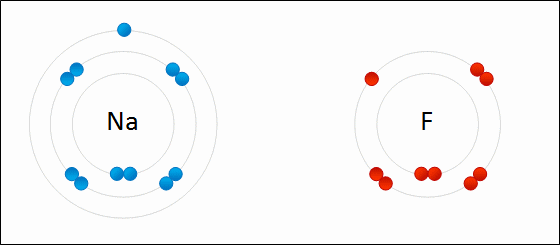
В случае если разница электроотрицательностей элементов будет велика, произойдет не просто смещение электронной плотности, а полная передача электрона от одного атома к другому. Рассмотрим это на примере фторида натрия NaF. Как мы видели ранее, атом натрия стремится отдать один электрон, а атом фтора готов его принять. Это легко осуществляется при их взаимодействии, которое сопровождается переходом электрона.
При этом атом натрия полностью передает свой электрон атому фтору: натрий лишается электрона и становится заряженным положительно, а хлор приобретает электрон и становится заряженным отрицательно. Определение Атомы и группы атомов, несущие на себе заряд, называют ионами. В образовавшейся молекуле — фториде натрия Na+F− — связь осуществляется за счет электростатического притяжения разноименно заряженных ионов. Такую связь называют ионной. Она реализуется между типичными металлами и неметаллами, то есть между атомами с сильно различающимися значениями электроотрицательности. Определение Ионная связь образована за счет сил электростатистического притяжения между разноименно заряженными ионами — катионами и анионами. Существует еще один тип связи — металлическая, характерная для простых веществ — металлов. Она характеризуется притяжением частично ионизованных атомов металлов и валентных электронов, образующих единое электронное облако («электронный газ»). Валентные электроны в металлах являются делокализованными и принадлежат одновременно всем атомам металла, свободно перемещаясь по всему кристаллу. Таким образом, связь является многоцентровой. В переходных металлах металлическая связь носит частично ковалентный характер, так как дополнена перекрыванием частично заполненных электронами d-орбиталей предвнешнего слоя. Металлы образуют металлические кристаллические решетки. О ней подробно рассказывается в теме «Металлическая связь и ее характеристики».
Определение Если исходные вещества вступают в химическое взаимодействие в строго определенных соотношениях, а в результате реакции образуются продукты, количество которых поддается точному расчету, то такие реакции называются стехиометрическими. Любая химическая формула и любое химическое уравнение в явном виде (с помощью индексов или коэффициентов) указывают молярные соотношения элементов, составляющих сложное вещество, или молярные соотношения различных участников реакции – исходных веществ и (или) продуктов. Все расчеты по химическим формулам и уравнениям основаны на использовании этих стехиометрических соотношений и связаны с нахождением количеств вещества (чисел молей).
Например, в оксиде серы (IV) один атом серы и два атома кислорода. То есть количество кислорода в два раза больше количества серы и можно записать: n(S)/n(O)=1/2 В оксиде серы (VI) один атом серы и три атома кислорода, соотношение элементов будет выглядеть по-другому: n(S)/n(O)=1/3 Следует подчеркнуть, что когда речь идет о соотношении элементов в молекуле, важно найти наименьшее общее кратное. Например, в щавелевой кислоте с общей формулой H2C2O4 соотношение элементов можно записать как: n(H): n(C): n(O) =2: 2: 4 Сократив на 2, получим истинное соотношение элементов: n(H): n(C): n(O) =1: 1: 2 Такой же принцип заключен и в коэффициентах химической реакции. Количество вещества по уравнению реакции (число молей) = коэффициенту перед соответствующей молекулой. Например, уравнение H3PO4+3NaOH=Na3PO4+3H2O означает, что при взаимодействии 1 моля фосфорной кислоты с 3 молями гидроксида натрия образуется 1 моль фосфата натрия и 3 моль воды. Это можно записать в виде формулы: n(H3PO4):n(NaOH):n(Na3PO4):n(H2O)=1:3:1:3 Другими словами, количества гидроксида натрия и воды в данной реакции равны: n(NaOH)=n(H2O), а количество фосфорной кислоты в три раза меньше количества гидроксида натрия: n(H3PO4)/n(NaOH)=1/3→3⋅n(H3PO4)=n(NaOH) Основываясь на этой пропорции и зная количество реагента, например фосфорной кислоты, можно установить количества остальных веществ, участвующих в реакции. При взаимодействии 3 моль фосфорной кислоты потребуется в три раза больше гидроксида натрия, то есть 9 моль. Этот принцип можно наглядно представить, если записать соотношения под уравнением реакции: H3PO4+3NaOH=Na3PO4+3H2O 1:3:1:3 3:?:?:? ⇓ 3:9:3:9 Задача 1 Сколько молекул оксида серы(VI) образуется при взаимодействии 112л оксида серы (IV) с кислородом? Решение Способ 1 1) Составим уравнение реакции: 2SO2+O2=2SO3 2) Над формулами веществ запишем известные и неизвестные величины с соответствующими единицами измерения: известен объем оксида серы (IV) (112л), нужно найти количество молекул оксида серы(VI) (Хмолекул). V=112л_N=Xмолекул _
2SO2(г)+O2(г)=2SO3(г)
3) n (SO2)=2моль n (SO3)=2моль Vm=22,4л/моль Na=6⋅1023молекул/моль V_=n⋅Vm=2⋅22,4л= 44,8л _N_=n⋅Na=2⋅6⋅1023= 12 ⋅ 1023молекул _ 4) Составим и решим пропорцию (ориентируясь на подчеркнутые числа) по условию задачи: 112л SO2 горит с выделением Х молекул SO3 по уравнению реакции: 44,8л SO2 - 12⋅1023 молекул SO3 112л/44,8л=Xмолек12⋅1023молек⟹ X=112л⋅12⋅1023молек /44,8л=30⋅1023молек Способ 2 1) Найдем количество оксида серы (IV) исходя из условий задачи: n(SO2)=V(SO2)/Vm=112л/22,4л/моль=5моль Поскольку нужно найти количество молекул оксида серы(VI) -N(SO3) - обозначим количество n(SO_3) за Х моль. Запишем известные количества веществ над соответствующими формулами веществ. Под формулами запишем количества этих веществ по уравнению реакции. При этом следует помнить, что количество вещества в реакции равно коэффициенту перед соответствующей формулой. n=5моль_n=Xмоль_ 2SO2(г)+O2(г)=2SO3(г) n=2моль_n=2моль_ 2) Составим пропорцию: по условию задачи: 5 моль SO2 приводит к образованию Х моль SO3 по уравнению реакции: 2 моль SO2 - 2 моль SO3 5моль /2моль=Xмоль/2моль⟹X=5моль⋅2моль/2моль=5моль 3) Зная число Авогдаро и количество окисда серы (VI), легко определить и количество молек-л: N(SO3)=n(SO3)⋅Na=5моль⋅6⋅1023молекул/моль=30⋅1023молекул Ответ: при сгорании 112л. оксида серы (IV) образуется 30⋅1023молекул оксида серы(VI) Следует подчеркнуть, что оба способа решения равнозначны и могут использоваться для решения расчетных задач по химическим уравнениям. Для решения более сложных, многоэтапных задач (например, в третьей части ЕГЭ по химии) рекомендуется использовать количества веществ. Задача 2 Сколько граммов воды образуется при сгорании 67,2л метана? Решение Способ 1 1) Составим уравнение реакции: CH4(г)+2O2(г)=CO2(г)+2H2O(ж) 2) Над формулами веществ запишем известные и неизвестные величины с соответствующими единицами измерения: известен объем метана (67,2л), нужно найти массу воды (Хг). V=67,2л_ m=Xг_ CH4(г)+2O2(г)=CO2(г)+2H2O(ж) 3) n=1моль n=2моль Vm=22,4л/моль M=18г/моль V_=n⋅Vm=1⋅22,4л=22,4л_m_=n⋅M=2⋅18=36г_ 4) Составим и решим пропорцию (ориентируясь на подчеркнутые числа) по условию задачи: 67,2л метана горит с выделением Х г воды по уравнению реакции: 22,4л метана - 36 г воды 67,2л 22,4л=Xг36г⟹X=67,2л⋅36г22,4л=108г Способ 2 Эту же задачу можно решить и через другую пропорцию, основанную на количествах веществ. Для этого, исходя из условий задачи, нужно найти количества веществ: метана и кислорода. 1) Найдем количество метана исходя из условий задачи: n(CH4)=V(CH4)/Vm=67,2л/22,4л/моль=3моль Поскольку нужно найти массу воды обозначим ее количество n(H2O) за Х моль. Запишем известные количества веществ (метана и воды) над соотвествующими формулами веществ. Под формулами запишем количества этих веществ по уравнению реакции. При этом следует помнить, что количество вещества в реакции равно коэффициенту перед соответствующей формулой. n=3моль_ n=Xмоль_ CH4(г)+2O2(г)=CO2(г)+2H2O(ж) n=1моль_ n=2моль_ 2) Составим пропорцию: по условию задачи: 5 моль метана приводит к образованию Х моль воды по уравнению реакции: 2 моль метана - 2 моль воды 3моль/1моль=Xмоль/2моль⟹X=3моль⋅2моль/1моль=6моль 3) Зная молярную массу воды и ее количество, легко определить ее массу: m(H2O)=n(H2O)⋅M(H2O)=6моль⋅18г/моль=108г Ответ: при сгорании 67,2л. метана образуется 108г. воды РАСЧЕТЫ ПО ХИМИЧЕСКИМ УРАВНЕНИЯМ (СОДЕРЖАНИЕ ПРИМЕСЕЙ) Определение Примеси- компоненты смеси, содержание которых гораздо меньше содержания основного компонента. Примесями также называют загрязняющие вещества; побочные продукты реакции и др. Задача 1 Определите объем кислорода, выделившегося в ходе реакции разложения 83г перманганат калия, содержащего 5% бескислородных примесей: 2KMnO4=K2MnO4+MnO2+O2 РЕШЕНИЕ 1) Так как примеси бескислородные, то при их разложении кислород выделяться не будет. Значит в первую очередь нужно определить массу чистого перманганат калия, то есть без примесей. Поскольку 83г - масса "грязного" перманганата калия, а 5% - содержание примесей, то массовая доля чистого вещества составит ω(KMnO4)(100-5)=95% или 0,095 2) Далее, по формуле определения массовой доли найдем массу чистого вещества: в-вав-васмесив-васмесив-ваωв-ва=mв-ваmсмеси(⋅100%)→mв-ва=mсмеси⋅ωв-ва
m(KMnO4)=m(смеси)⋅ω(KMnO4)=83г⋅0.95=79г 3) Найдем количество перманганат калия, вступившего в реакцию: n(KMnO4)=m(KMnO4)M(KMnO4)=79г158г/моль=0.5моль 4) Составим пропорцию, обозначив количество кислорода n(O2)=X моль: по уравнению реакции: при разложении 2 моль KMnO4 выделяется 1 моль O2 по условию задачи: 0,5 моль KMnO4------Х моль O2 мольмольмольмольмольмольмольмоль2моль0,5моль=1мольXмоль→X=0,5моль⋅1моль2моль=0.25моль 5. Найдем объем кислорода: мольл/мольлV(O2)=n(O2)⋅Vm=0.25моль⋅22.4л/моль=5.6л ОТВЕТ: выделится 5,6л кислорода РАСЧЕТЫ ПО ХИМИЧЕСКИМ УРАВНЕНИЯМ (ПРАКТИЧЕСКИЙ ВЫХОД) Понятие практический выход используется только для продуктов реакции и означает отклонение массы(объема) продукта от теоретически возможного. Это отклонение связано с погрешностями проведения эксперимента и присутствует во всех реакциях. практич.теорет.практич.теорет.η=mпрактич.mтеорет.η=Vпрактич.Vтеорет. Практический выход всегда меньше теоретического (меньше 100%). Решение подобных задач всегда следует начинать с определения теоретической массы (объема) продукта реакции, и уже потом находить отношение практической массы(объему) к теоретической. Например,: Задача 2 При взаимодействии 13г цинка с соляной кислотой образовалось 26,5г соли. Определите практический выход продукта. РЕШЕНИЕ Zn+2HCl=ZnCl2+H2 1) Составим уравнение реакции: Zn+2HCl=ZnCl2+H2 2) Запишем дано и расставим известные величины над веществами в уравнении реакции. Поскольку требуется найти практический выход ZnCl2 и дана его практическая масса, обозначим его теоретическую массу за Хг: Дано: гтеор.гm=13г_mтеор.=Xг_ m(Zn) = 13г Zn+2HCl=ZnCl2+H2 mпракт.практ.(ZnCl2) = 26,5г мольмольn=1мольn=1моль Найти: г/мольг/мольM=65г/мольM=136г/моль η(ZnCl2) -? ггm=65г_m=136г_ ______________________ 3) Составим пропорцию: по условию задачи 13 г цинка - Хг ZnCl2 Определение Поэтому, если количество вещества меньше стехиометрического, вещество находится в недостатке и все количество расходуется в ходе реакции. Если вещества больше, чем нужно стехиметрически, то оно находится в избытке; при этом избыточное количество этого вещества в реакции не участвует. Рассмотрим это на примере: KOH+KNO3=KNO3+H2O Из коэффициентов реакции следует, что количества гидроксида калия и азотной кислоты должны быть равны: n(KOH)=n(HNO3) Это и есть стехиометрическое соотношение реагентов (1:1) Если реакции будет участвовать 3 моль гидроксида калия, то потребуется 3 моль азотной кислоты. Предположим, что для проведения реакции взяли 1,5 моль KOH и 1 моль азотной кислоты. Из стехиометрического соотношения реагентов следует, что для взаимодействия с 1 моль HNO3 потребуется 1 моль KOH. В условии же говорится, что взяли 1,5 моль KOH, то есть больше, чем нужно. Значит 1,5 моль KOH в избытке. При этом избыточное количество (1,5 моль- 1 моль)=0,5 моль KOH в реакции не участвует, но присутствует в реакционной смеси. В то же время, азотная кислота находится в недостатке: для взаимодействия с 1,5 моль KOH потребуется 1,5 моль кислоты, а взяли ее всего 1 моль, т.е. меньше, чем нужно. Задачи на избыток и недостаток легче всего определить по условию задачи: даны массы (объемы) для двух или более реагентов. При решении таких задач важно помнить, что если один реагент находится в избытке, то другой обязательно - в недостатке! Решать такие задачи лучше через количества веществ, расчет ведут по недостатку. Задача 3 Определите массу соли, образующейся в ходе взаимодействия 22г кальция с 635 мл 5%-ного раствора соляной кислоты (плотность раствора 1,17 г/мл)? РЕШЕНИЕ Дано: m(Ca)=22г Vp−pa=635мл ρp−pa=1,15г/мл ω(HCl)=5 Найти: m(CaCl2) -? Решение: 1) Составим уравнение реакции: Ca+2HCl=CaCl2+H2 Так как дана масса кальция и масс раствора соляной кислоты, нужно определить какой из реагентов взят в избытке, а какой - в недостатке. Определить это легче всего по количествам веществ. 2) Найдем количество кальция: гг/мольмольn(Ca)=m(Ca)M(Ca)=22г40г/моль=0,55моль Чтобы найти количество соляной кислоты сначала найдем ее массу: р-рар-ра(р-рамлг/млгm(HCl)=m(р-ра)⋅ω(HCl)=V(р-ра)⋅ρ(р-ра)⋅ω(HCl)=635мл⋅1,15г/мл⋅0,05=36,5г гг/мольмольn(HCl)=m(HCl)M(HCl)=36,5г36,5г/моль=1моль По уравнению реакции n(Ca)n(HCl)=12, откуда n(Ca)=n(HCl)2. Из условия задачи, было найдено, что мольn(HCl)=1моль, значит на 1 моль соляной кислоты потребуется (теоретически) n(Ca)=n(HCl)2=12=0,5 моль кальция. В действительности же, в реакции участвует 0,55 моль кальция, то есть больше, чем нужно по стехиометрии (0,55 > 0,5), значит кальций находится в избытке. Соляная кислота - в недостатке. 3) Дальнейший расчет ведем по соляной кислоте, так как она находится в недостатке и в ходе реакции прореагирует полностью. Составим пропорцию: по уравнению реакции 2 моль соляной кислоты приводит к образованию 1 моль CaCl2 по условию задачи 1 моль соляной кислоты — Х мольCaCl2 мольмольмольмольмольмольмольмоль2моль1моль=1мольXмоль→X=1моль⋅1моль2моль=0.5моль 4) Вычислим массу соли, зная ее массу: мольг/мольm(CaCl2)=n(CaCl2)⋅M(CaCl2)=0.5моль⋅111г/моль=55,5г
РАСЧЕТЫ ПО ХИМИЧЕСКИМ УРАВНЕНИЯМ (МАССОВАЯ ДОЛЯ ПРОДУКТА) Задача (ЕГЭ, тип С4) 7г меди взаимодействует с 31мл раствором концентрированной азотной кислоты (содержание кислоты 56%) плотностью 1,4г/мл. (конц.) Cu+4HNO3(конц.)=Cu(NO3)2+2NO2+2H2O Определите массовую долю соли в полученном растворе. Решение Дано: m(Cu)=7г Vp−pa=31мл ρp−pa=1,4г/мл ω(HNO3)=56 Найти: ω(Cu(NO3)2) -? Решение: 1) Составим уравнение реакции: (конц.)Cu+4HNO3(конц.)=Cu(NO3)2+2NO2+2H2O Так как дана масса меди и раствора азотной кислоты, нужно определить какой из реагентов взят в избытке, а какой - в недостатке. Определить это легче всего по количествам веществ. 2) Найдем количество меди: гг/мольмольn(Cu)=m(Cu)M(Cu)=7г63,5г/моль=0,11моль Чтобы найти количество азотной кислоты сначала найдем ее массу: р-рар-ра(р-рамлг/млгm(HNO3)=m(р-ра)⋅ω(HNO3)=V(р-ра)⋅ρ(р-ра)⋅ω(HNO3)=31мл⋅1,4г/мл⋅0,56=24,3г гг/мольмольn(HNO3)=m(HNO3)M(HNO3)=24,3г63г/моль=0,39моль По уравнению реакции n(Cu)n(HNO3)=14, откуда n(Cu)=n(HNO3)4. Из условия задачи, было найдено, что мольn(HNO3)=0,39моль, значит на 0,39 моль азотной кислоты потребуется (теоретически) n(Cu)=n(HNO3)4=0,394=0,098 моль меди. В действительности же, в реакции участвует 0,11 моль меди, то есть больше, чем нужно по стехиометрии (0,11 > 0,098), значит медь находится в избытке. Азотная кислота - в недостатке. 3) Дальнейший расчет ведем по азотной кислоте, так как она находится в недостатке и в ходе реакции прореагирует полностью. Составим пропорцию: по уравнению реакции 4 моль азотной кислоты приводит к образованию 1 моль Cu(NO3)2 по условию задачи 0,39 моль азотной кислоты — Х мольCu(NO3)2 мольмольмольмольмольмольмольмоль4моль0,39моль=1мольXмоль→X=0,39моль⋅1моль4моль=0.098моль 4) Вычислим массу соли, зная ее массу: мольг/мольm(Cu(NO3)2)=n(Cu(NO3)2)⋅M(Cu(NO3)2)=0.098моль⋅193,5г/моль=19 г 5) Вычислим массу полученного раствора. Поскольку оксид азота - газ (улетит), а неизрасходованная медь останется в осадке, то масса полученного раствора: m_{(\text{конечного p-pa})}= m(H_2O} + m(Cu(NO_3)_2)m_{(\text{конечного p-pa})}= m(H_2O} + m(Cu(NO_3)_2) По уравнению реакции вычисляем количество вещества и массу получившейся воды: n(H2O)=2⋅0,39|4=0,195 моль, m(H2O)=0,195⋅18=3,51 г. Теперь можем вычислить массу конечного раствора: кон. p-paгm(кон. p-pa)=m(Cu(NO3)2)+m(H2O)=3,51+19=22,51г 6) Зная массу полученного раствора и массу соли в нем, легко вычислить массовую долю соли: кон. p-paггω(Cu(NO3)2)=m(Cu(NO3)2)m(кон. p-pa)=19г22,51г=0,844=84,4% Ответ: массовая доля соли в полученном растворе 84,4% Основные формулы
Для решения расчетных задач лучше всего использовать формулу, связывающую большинство величин через количество вещества: n=m/M=V/Vm=N/NA Задача 1 Какова масса 3 моль кислорода? Решение n(O2)=3 m(O2) n=mM⇒m=n⋅M O2 M(O2)=Mr(O2)=2⋅Ar(O)=2⋅16=32 m(O2)=n(O2)⋅M(O2)=3моль⋅32г/моль=96г Ответ: масса 3 моль кислорода - 96г Задача 2 Какой объем занимает 34г аммиака? Сколько молекул содержится в этом объеме? Решение Дано: m(NH3)=34г Найти: V(NH3) =? N(NH3) =? Решение: Такие задачи удобнее всего решать через нахождение количества вещества, в моль. 1) Найдем количество аммиака, которое содержится в указанной массе: гг/мольмольn(NH3)=m(NH3)M(NH3)=34г17г/моль=2моль 2) Зная количество вещества, легко найти его объем: л/мольмольлV(NH3)=Vm⋅n(NH3)=22,4л/моль⋅2моль=44,8л частиц/мольмольмолекулN(NH3)=Na⋅n(NH3)=6,02⋅1023частиц/моль⋅2моль=12⋅1023молекул Ответ: 34 г аммиака занимает объем, равный 44,8л и содержит 12⋅1023 молекул Массовая доля как понятие
Например, кусок арбуза, изображенный на рисунке, составляет одну четверть от целого арбуза, то есть его доля равна 1/4 или 25%. Чтобы лучше понять, что такое массовая доля представьте себе килограмм конфет (1000г), который мама купила своим трем детям. Из этого килограмма самому младшему ребенку досталась половина всех конфет (несправедливо конечно!). Старшему — лишь 200г, а среднему — 300г. Значит массовая доля конфет у младшего ребенка составит половину, или 1/2 или 50%. У среднего ребенка будет 30%, а у старшего — 20%. Следует подчеркнуть, что массовая доля может быть безразмерной величиной (четверть, половина, треть, 1/5, 1/6 и т.д.), а может измеряться в процентах (%). При решении расчетных задач массовую долю лучше переводить в безразмерную величину. Задача Сколько граммов сахара и воды нужно взять для приготовления 150г 10%-ного раствора сахара? Решение ДАНО: m(р-ра)=150г ω(сахара)=10%=0,1 НАЙТИ: m(сахара)=? m(воды)=? РЕШЕНИЕ: m(сахара) = (сахара)ггω(сахара)⋅m(p−pa)=0,1⋅150г=15г m(воды)=m(р-ра) - m(сахара) = 150г - 15г=135г. ОТВЕТ: нужно взять 15г сахара и 135г воды. Задача Раствор объемом 350 мл. и плотностью 1, 142 г/мл содержит 28 г хлорида натрия. Найти массовую долю соли в растворе. Решение ДАНО: V(р-ра)=350 мл. ρ(р-ра)=1,142 г/мл m(NaCl)=28 г НАЙТИ: ω(NaCl)=? РЕШЕНИЕ: m(р-ра) =V(р-ра) ⋅ρ(р-ра)=350 мл ⋅ 1,142 г/мл=400г (р-ра)ггω(NaCl)=m(NaCl)m(р-ра)=28г/400г=0,07=7% ОТВЕТ: массовая доля хлорида натрия ω(NaCl)=7% МАССОВАЯ ДОЛЯ ЭЛЕМЕНТА В МОЛЕКУЛЕ Формула химического вещества, например H2SO4, несет в себе много важной информации. Она обозначает либо отдельную молекулу вещества, которая характеризуется относительной атомной массой, либо 1 моль вещества, который характеризуется молярной массой. Формула показывает качественный (состоит из водорода, серы и кислорода) и количественный состав (состоит из двух атомов водорода, атома серы и четырех атомов кислорода). По химической формуле можно найти массу молекулы в целом (молекулярную массу), а также вычислить соотношение масс элементов в молекуле: m(H): m(S): m(O) = 2: 32: 64 = 1: 16: 32. При вычислении соотношений масс элементов нужно учитывать их атомную массу и количество соответствующих атомов: m(H2)=1∗2=2, m(S)=32∗1=32, m(O4)=16∗4=64 Принцип расчета массовой доли элемента аналогичен принципу расчета массовой доли вещества в растворе и находится по схожей формуле: эл-таэл-та(атомовмолекулыωэл-та=Arэл-та⋅n(атомов)mмолекулы(⋅100%) Задача Найти массовую долю элементов в серной кислоте. Решение Способ 1 (пропорция): Найдем молярную массу серной кислоты: M(H2SO4)=1⋅2+32+16⋅4=98г/моль
Одна молекула серной кислоты содержит один атом серы, значит масса серы в серной кислоте составит: г/моль m(S)=Ar(S)⋅n(S)=32г/моль⋅1= 32г/моль Примем массу всей молекулы за 100%, а массу серы — за Х% и составим пропорцию: M(H2SO4)=98 г/моль — 100% m(S) = 32г/моль — Х% Откуда г/мольг/мольX=32г/моль⋅100%98г/моль=32,65%=32% Способ 2 (формула): эл-та(атомовмолекулыг/мольг/моль ω(S)=Arэл-та⋅*n(атомов)/mмолекулы*(⋅100%) =Ar(S)⋅1/M(H2SO4) *(⋅100%)=32г/моль⋅1/98г/моль(⋅100%)≈32,7% Аналогично по формуле рассчитаем массовые доли водорода и кислорода: г/мольг/мольω(H)=Ar(H)⋅2M(H2SO4)(⋅100%)=1г/моль⋅298г/моль(⋅100%)≈2% г/мольг/мольω(O)=Ar(O)⋅4M(H2SO4)(⋅100%)=16г/моль⋅498г/моль(⋅100%)≈65,3%
Термохимические уравнения Определение Термохимические уравнения — уравнения химических реакций с указанием теплового эффекта реакции. Например: гггжкДжCH4(г)+2O2(г)=CO2(г)+2H2O(ж)+890кДж
гггкДж2H2(г)+O2(г)=2H2O(г)+572кДж
гггкДжN2(г)+O2(г)⇔2NO(г)−180кДж
тггкДжS(т)+O2(г)=SO2(г)+297кДж Следует помнить, что тепловой эффект — стандартная величина для определенной реакции. Точные значения можно найти в справочнике физико-химических величин. При этом тепловой эффект реакции пропорционален количеству реагентов и продуктов. Например, в реакции ггкДж3O2(г)⇔2O3(г)−284кДж
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 227; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.16.254 (0.308 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||



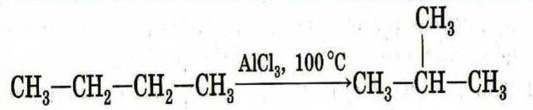



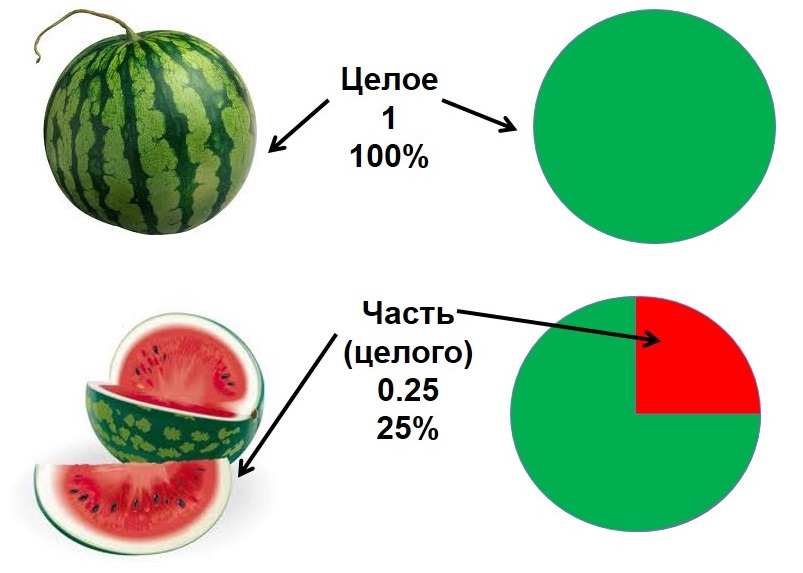 Понятие "доли" наверняка вам уж знакомо.
Понятие "доли" наверняка вам уж знакомо.


