Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
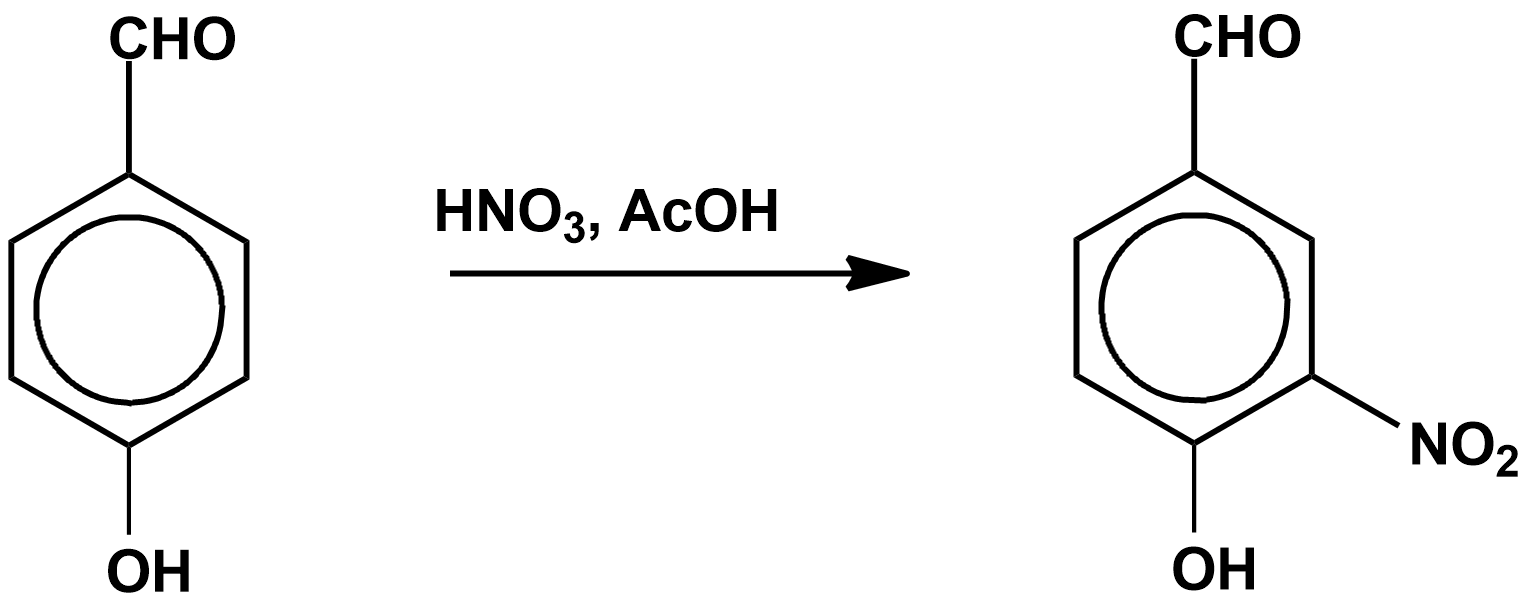
Нитрование смесью азотной и уксусной кислотСодержание книги
Поиск на нашем сайте
Этим методом нитруют активные арены, например, фенол, гидроксибензальдегид, салициловую кислоту, фуран, пиррол, производные нафталина, антрацен и другие.
НИТРОВАНИЕ РАЗБАВЛЕННОЙ АЗОТНОЙ КИСЛОТОЙ Разбавленной азотной кислотой, в которой практически полностью отсутствуют ионы нитрония, можно нитровать реакционноспособные арены (фенолы и амины). Нитрование протекает по механизму " нитрозирование – окисление ".
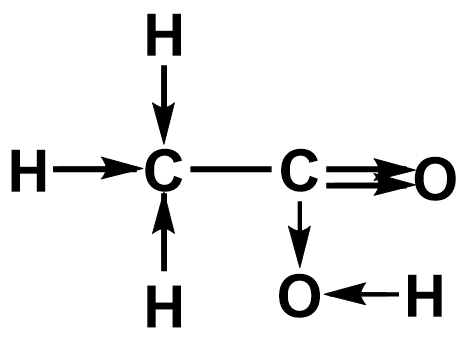
Методы определения СТЕПЕНИ ОКИСЛЕНИЯ АТОМА УГЛЕРОДА В ОРГАНИЧЕСКИХ СОЕДИНЕНИЯХ Валентность в органических соединениях измеряется числом ковалентных химических связей, в том числе возникших и по донорно-акцепторному механизму. Во многих органических соединениях степень окисления атома углерода не совпадает с числом образуемых им связей. В соответствии с теорией химического строения органических соединений валентность углерода всегда равна IV (образует четыре связи). В то же время степень окисления углерода в метане CH4 равна –4, метаноле CH3OH — –2, в формальдегиде CH2O — 0, в муравьиной кислоте HCOOH — +2. Определение Степень окисления — условный заряд атома в молекуле, который получает атом в результате полной отдачи (принятия) электронов, вычисленный из предположения, что все связи имеют ионный характер. Для определения степени окисления (СО) атомов в молекулах органических веществ существует несколько способов:
Они позволяют учитывать СО каждого атома углерода в цепочке связей, используются при решении окислительно-восстановительных уравнений (ОВР). Алгебраический метод Этот метод наиболее применим в том случае, если все атомы углерода органического вещества по окончании реакции приобрели одинаковую степень окисления (реакции горения или полного окисления). Вычисления производятся по брутто-формулам, например, рассмотрим алгоритм определения степеней окисления атомов в молекуле метанола: 1. Формулу метанола CH3–OH «сворачиваем» и записываем в виде CH4O. 2. Проставляем степени окисления водорода и кислорода (они постоянные): CH4+O−2. 3. По разности суммарных зарядов получаем (+1)⋅4+(−2)⋅1=+2.
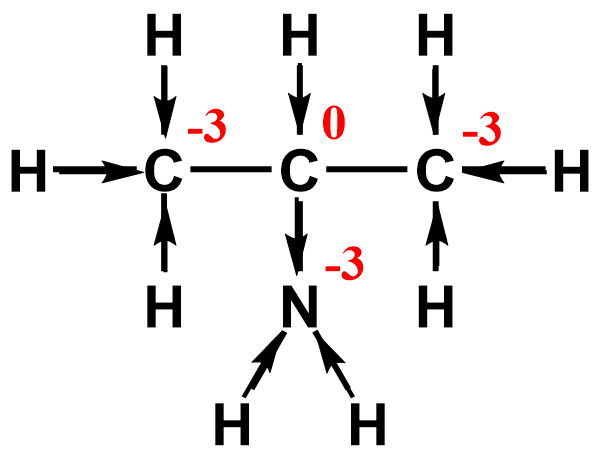
Поскольку в молекуле один атом углерода, следовательно, его заряд равен –2. Графический метод 1. Изображаем полную структурную формулу вещества. 2. Стрелкой показываем смещение электрона к наиболее электроотрицательному элементу вдоль каждой связи. 3. Считаем все связи С–С неполярными. 4. Анализируем. Сколько стрелок направлено к атому — столько отрицательных зарядов «–», сколько стрелок направлено от атома — столько положительных зарядов «+». Сумма «–» и «+» определяет степень окисления атома.
Например, в молекуле этановой (уксусной) кислоты углерод карбоксильной группы смещает от себя 3 электрона, его степень окисления +3, углерод метильного радикала притягивает к себе 3 электрона от водорода, его степень окисления — 3.
|
|||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 203; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.250.57 (0.01 с.) |