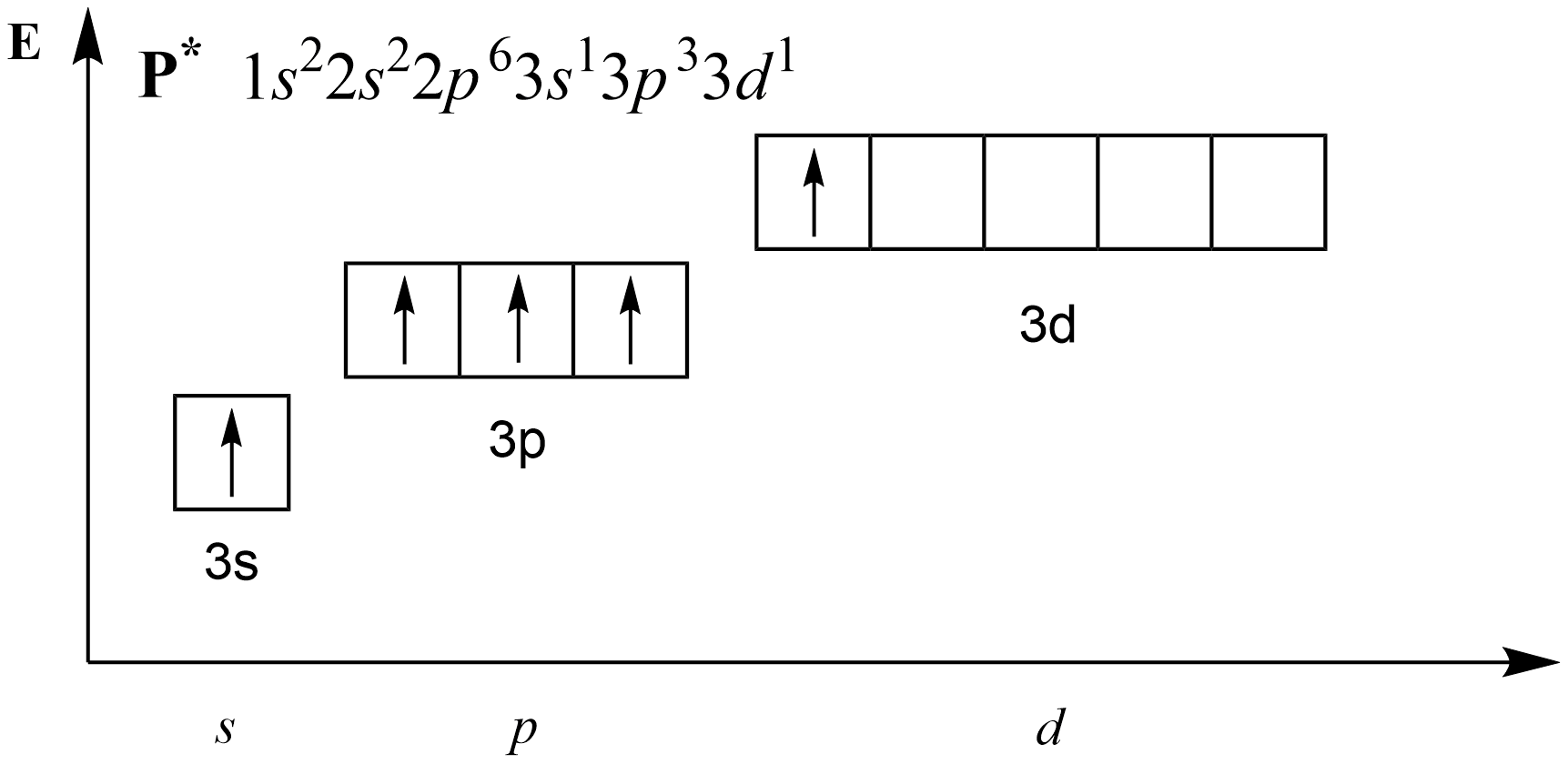Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Валентные возможности фосфора
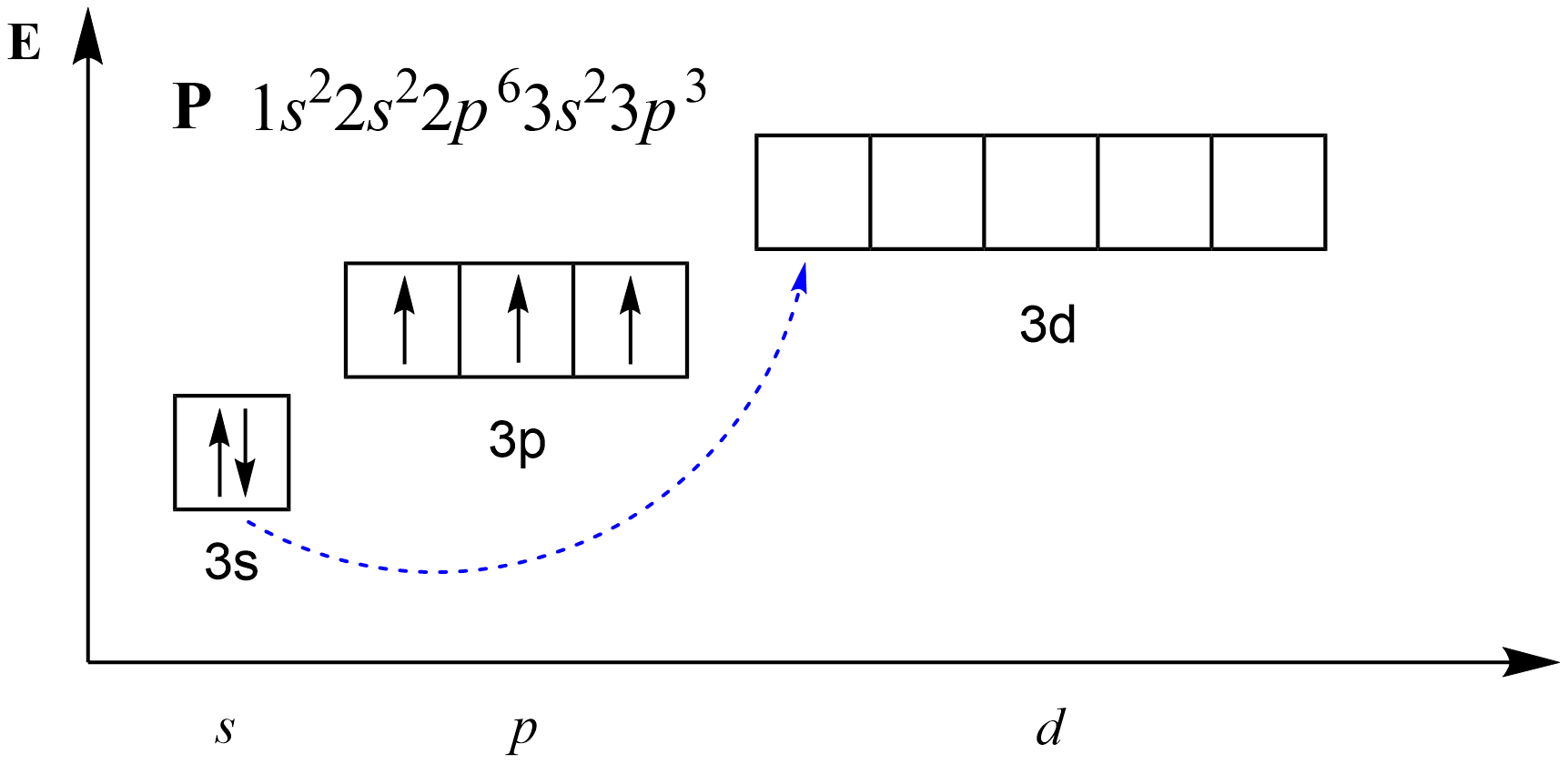
Элемент фосфор находится в третьем периоде, в главной подгруппе пятой группы. Электронная конфигурация его валентных электронов 3s23p3 или
Являясь аналогом азота, фосфор также может проявлять валентности I, II, III и IV. Но так как для элементов третьего периода доступны вакантные 3d-орбитали, атом фосфора может перейти в возбужденное состояние, переведя один из s-электронов на d-подуровень:
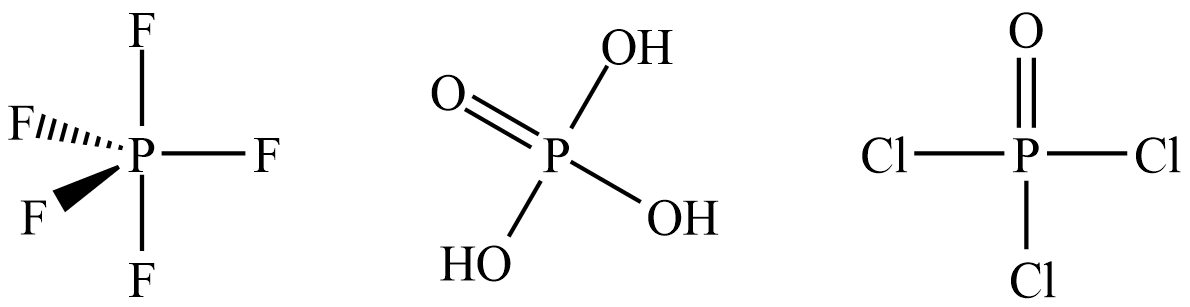
Таким образом, атом фосфора может образовать пять ковалентных связей по обменному механизму. Максимальную валентность V фосфор проявляет, например, в таких молекулах как PF5, H3PO4, POCl3 и др.:
СТЕПЕНЬ ОКИСЛЕНИЯ Определение Степень окисления - это условный заряд атома в соединении в предположении, что все связи в этом соединении ионные (т.е. все связывающие электронные пары полностью смещены к атому более электроотрицательного элемента). Другими словами, степень окисления - это число, которое показывает, сколько электронов отдал (заряд «+») или принял (заряд «–») атом при образовании химической связи с другим атомом. В отличие от валентности, степень окисления имеет знак - она может быть отрицательной, нулевой или положительной. Для подсчета степеней окисления атомов в соединении имеется ряд простых правил:
Высшая положительная степень окисления равна, как правило, номеру группы элемента в периодической системе. Так, сера (элемент VIA группы), проявляет высшую степень окисления +6, азот (элемент V группы) - высшую степень окисления +5, марганец - переходный элемент VIIБ группы - высшую степень окисления +7. Это правило не распространяется на элементы побочной подгруппы первой группы, степени окисления которых обычно превышают +1, а также на элементы побочной подгруппы VIII группы. Также не проявляют своих высших степеней окисления, равных номеру группы, элементы кислород и фтор.
Низшая отрицательная степень окисления для элементов-неметаллов определяется вычитанием номера группы из числа 8. Так, сера (элемент VIA группы), проявляет низшую степень окисления −2, азот (элемент V группы) - низшую степень окисления −3. На основании приведенных выше правил можно найти степень окисления элемента в любом веществе. Пример 1 Найти степень окисления серы в кислотах H2SO3, H2S2O5, H2S3O10. РЕШЕНИЕ Очевидно, что степень окисления водорода равна +1, кислорода −2. Обозначим степень окисления серы как q. Тогда можно записать: 2⋅(+1)+q+3⋅(−2)=0q=+4 2⋅(+1)+2q+5⋅(−2)=0q=+4 2⋅(+1)+3q+10⋅(−2)=0q=+6 Таким образом, в первых двух кислотах степень окисления серы одинакова и равна +4, в последней кислоте +6. Пример 2 Найти степень окисления хлора в соединениях: а) KClO3; б) Ca(ClO4)2; в) Al(ClO2)3. РЕШЕНИЕ Сначала найдем заряд сложных ионов, в состав которых входит хлор, помня при этом, что молекула в целом электронейтральна. H+1ClO3⏞Ca+2(ClO4)⏞2Al+3(ClO2)⏞3 +1+x=0+2+2x=0+3+3x=0 x=−1x=−1x=−1 (xClO3−2)−1 Алгоритм определения степени окисления и валентности элемента в соединении
|
|||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 661; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.98.71 (0.005 с.) |